В химии pH - это логарифмическая шкала, используемая для определения кислотности среды. Это приблизительно отрицательный логарифм по основанию 10 молярной концентрации, измеренной в единицах молей на литр ионов водорода. Его также можно назвать показателем кислотности среды. Точнее, это отрицательный логарифм по основанию 10 активности иона водорода. При 25 °С растворы с рН менее 7 являются кислотными, а растворы с рН более 7 являются основными. Нейтральное значение pH зависит от температуры и составляет менее 7 при повышении температуры. Чистая вода нейтральна, pH=7 (при 25 °C), не является ни кислотой, ни щелочью. Вопреки распространенному мнению, значение pH может быть меньше 0 или больше 14 для очень сильных кислот и оснований соответственно.
Применение
 Вам будет интересно:«Кореш» — это обращение к лучшим друзьям
Вам будет интересно:«Кореш» — это обращение к лучшим друзьям

Измерения pH важны в агрономии, медицине, химии, водоподготовке и многих других сферах.
Шкала рН актуальна для набора стандартных растворов, кислотность которых устанавливается международным соглашением. Первичные стандартные значения рН определяются с помощью концентрационной ячейки с переносом путем измерения разности потенциалов между водородным электродом и стандартным электродом, таким как из хлорида серебра. PH водных растворов можно измерять стеклянным электродом и pH-метром или индикатором.
Открытие
 Вам будет интересно:Значение фразеологизма "истину глаголишь"
Вам будет интересно:Значение фразеологизма "истину глаголишь"
Концепция pH была впервые введена датским химиком Сереном Петером Лаурицем Серенсеном в лаборатории Carlsberg в 1909 году и пересмотрена до современного уровня pH в 1924 году, чтобы приспособить определения и измерения в терминах электрохимических ячеек. В первых работах нотация имела букву H в нижнем регистре p, а значит: pH.
Происхождение названия
Точное значение буквы p оспаривается, но согласно Carlsberg Foundation pH означает «мощность водорода». Также было высказано предположение, что р означает немецкое слово potenz («власть»), другие относятся к французскому пуисансу (также означает «власть», основываясь на том факте, что лаборатория Карлсберга была французской). Другое предположение состоит в том, что р относится к латинскому термину pondus hydroii (количество водорода), potentio hydroii (емкость водорода) или potential hydroli (водородный потенциал). Также предполагается, что Серенсен использовал буквы p и q (обычно сопряженные буквы в математике) просто для обозначения тестового решения (p) и эталонного решения (q). В настоящее время в химии р обозначает десятичный логарифм, а также используется в термине рКа, используемом для констант диссоциации кислотности среды.
 Вам будет интересно:Бугай — это слово ругательное или комплимент?
Вам будет интересно:Бугай — это слово ругательное или комплимент?
Вклад американцев
Бактериолог Элис Эванс, известная влиянием своей работы на молочные продукты и безопасность пищевых продуктов, поблагодарила Уильяма Мэнсфилда Кларка и его коллег за разработку методов измерения pH в 1910-х годах, которые впоследствии оказали широкое влияние на лабораторное и промышленное использование. В своих мемуарах она не упоминает, как много или как мало Кларк и его коллеги знали о работе Соренсена за несколько лет до этого. Уже в то время учеными активно изучался вопрос кислотности/щелочности среды.
Влияние кислоты
Внимание доктора Кларка было направлено на влияние кислоты на рост бактерий. И благодаря этому он дополнил представление тогдашней науки о водородном показателе кислотности среды. Он обнаружил, что именно интенсивность кислоты с точки зрения концентрации ионов водорода влияет на их рост. Но существующие методы измерения кислотности среды определяли количество, а не интенсивность кислоты. Затем со своими коллегами доктор Кларк разработал точные методы измерения концентрации ионов водорода. Эти методы заменили неточный метод титрования для определения содержания кислоты в биологических лабораториях по всему миру. Также было обнаружено, что они могут использоваться во многих промышленных и других процессах, в которых они получили широкое применение.
Практический аспект
Первый электронный метод измерения pH был изобретен Арнольдом Орвиллом Бекманом, профессором Калифорнийского технологического института, в 1934 году. Именно в этот момент местный производитель цитрусовых Sunkist захотел лучший метод для быстрой проверки pH лимонов, которые они собирали в близлежащих садах. Влияние кислотности среды при этом всегда учитывалось.
Например, для раствора с активностью ионов водорода 5 × 10–6 (на этом уровне это, по сути, число молей ионов водорода на литр раствора), получаем 1 / (5 × 10-6) = 2 × 105. Таким образом, такой раствор имеет рН, равный 5,3. Считается, что массы моля воды, моля ионов водорода и моля гидроксид-ионов составляют соответственно 18 г, 1 г и 17 г, количество чистых 107 молей (pH 7) воды содержит около 1 г диссоциированных ионов водорода (или, точнее, 19 г ионов H3O + гидрония) и 17 г ионов гидроксида.
Роль температуры
 Вам будет интересно:Момент силы - это... Физический смысл, условие равновесия тел, пример задачи
Вам будет интересно:Момент силы - это... Физический смысл, условие равновесия тел, пример задачи
Обратите внимание, что рН зависит от температуры. Например, при 0 °C pH чистой воды составляет 7,47. При 25 °C - 7, а при 100 °C - 6,14.
Потенциал электрода пропорционален pH, когда pH определяется с точки зрения активности. Точное измерение pH представлено в международном стандарте ISO 31-8.
Гальваническая ячейка настроена для измерения электродвижущей силы (ЭДС) между электродом сравнения и электродом, чувствительным к активности ионов водорода, когда они оба погружается в тот же водный раствор. Электрод сравнения может представлять собой объект из хлорида серебра или каломельный электрод. Водородно-ионный селективный электрод является стандартным для подобных операций.

Чтобы применить этот процесс на практике, используется стеклянный электрод, а не громоздкий водородный. Он имеет встроенный электрод сравнения. Он также откалиброван по буферным растворам с известной активностью ионов водорода. ИЮПАК предложил использовать набор буферных растворов с известной активностью Н+. Два или более буферных раствора используются для того, чтобы учесть тот факт, что наклон может немного отличаться от идеального. Чтобы реализовать этот подход к калибровке, электрод сначала погружают в стандартный раствор, и показания рН-метра устанавливают равными значению стандартного буфера.
Что дальше?
Показание из второго стандартного буферного раствора затем корректируется с использованием контроля наклона, чтобы быть равным уровню pH для этого раствора. Когда используется более двух буферных растворов, электрод калибруется путем подгонки наблюдаемых значений pH к прямой линии относительно стандартных значений буфера. Коммерческие стандартные буферные растворы обычно поставляются с информацией о значении при 25 °C и поправочном коэффициенте, который следует применять для других температур.
Характеристика определения
Шкала pH является логарифмической и, следовательно, pH является безразмерной величиной, часто используемой в том числе и для измерения кислотности внутренней среды клетки. Именно таким было первоначальное определение Соренсена, которое было заменено в 1909 году.
Однако можно напрямую измерять концентрацию ионов водорода, если электрод калибруется в терминах концентраций ионов водорода. Один из способов сделать это, который широко использовался, состоит в том, чтобы титровать раствор известной концентрации сильной кислоты раствором известной концентрации сильной щелочи в присутствии относительно высокой концентрации фонового электролита. Поскольку концентрации кислоты и щелочи известны, легко рассчитать концентрацию ионов водорода, чтобы потенциал мог быть соотнесен с измеренной величиной.

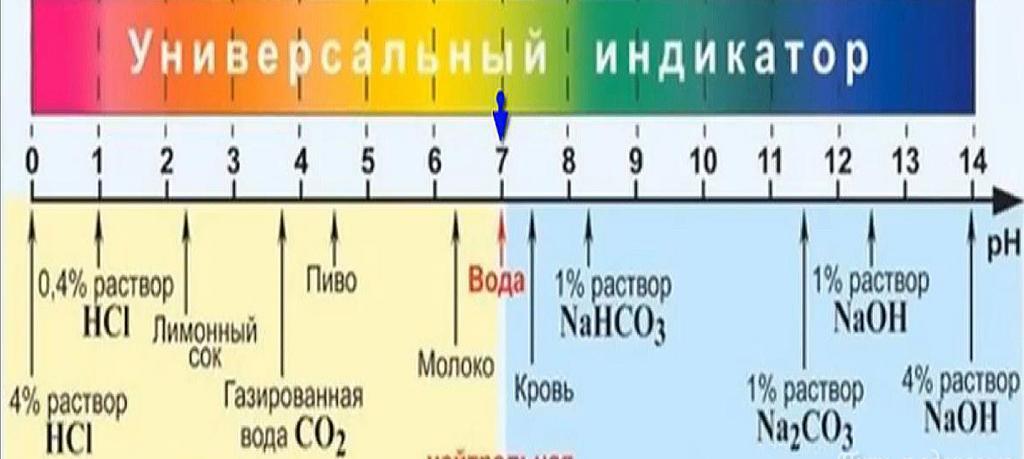
Индикаторы могут быть использованы для измерения pH, используя тот факт, что их цвет меняется. Визуальное сравнение цвета тестируемого раствора со стандартной цветовой шкалой позволяет измерять pH с точностью до целого числа. Более точные измерения возможны, если цвет измеряется спектрофотометрически с использованием колориметра или спектрофотометра. Универсальный индикатор состоит из смеси индикаторов, так что происходит постоянное изменение цвета примерно от pH 2 до pH 10. Универсальная индикаторная бумага изготовлена из впитывающей бумаги, которая была пропитана универсальным индикатором. Другой метод измерения pH - использование электронного pH-метра.
Уровни измерения
Измерение рН ниже примерно 2,5 (около 0,003 моль кислоты) и выше примерно 10,5 (около 0,0003 моль щелочи) требует специальных процедур, поскольку при использовании стеклянного электрода закон Нернста нарушается при таких величинах. Этому способствуют различные факторы. Нельзя предполагать, что потенциалы жидкостного перехода не зависят от pH. Кроме того, экстремальный pH означает, что раствор концентрируется, поэтому на потенциалы электродов влияет изменение ионной силы. При высоком pH стеклянный электрод может быть подвержен щелочной ошибке, поскольку электрод становится чувствительным к концентрации катионов, таких как Na+ и K+ в растворе. Доступны специально сконструированные электроды, которые частично преодолевают эти проблемы.

Сток из шахт или шахтных отходов может привести к очень низким значениям рН.
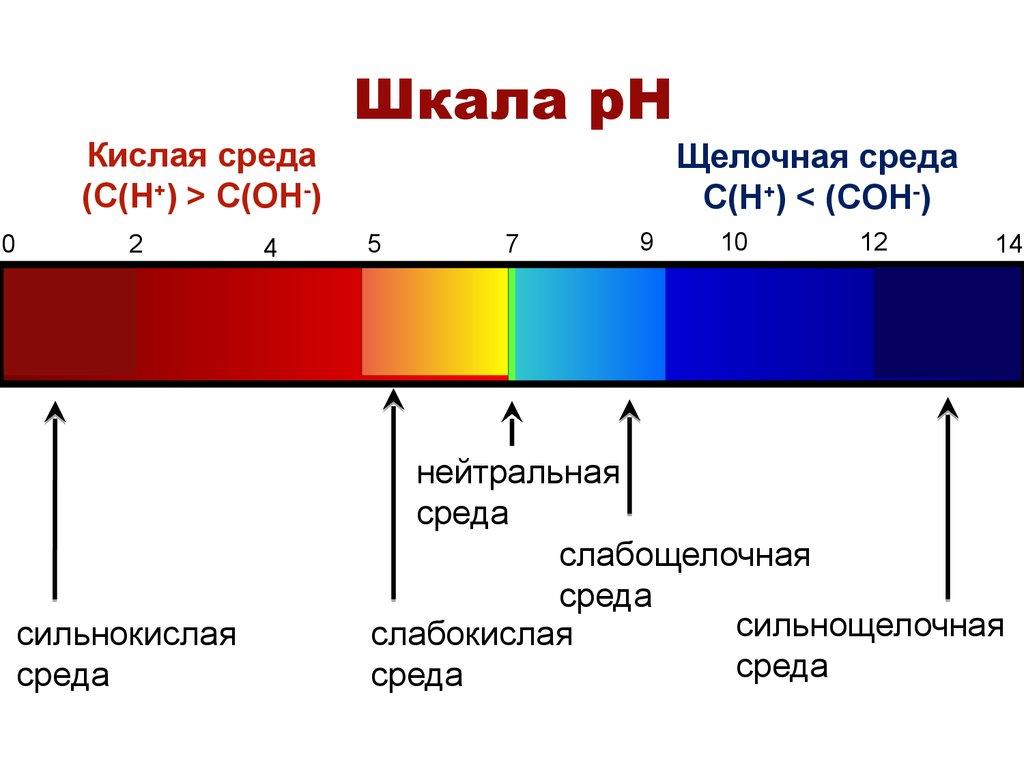
Чистая вода нейтральна. Она не является кислотной средой. Когда кислота растворяется в воде, pH будет ниже 7 (25 °C). Когда щелочь растворяется в воде, pH будет больше 7. Раствор сильной кислоты, такой как соляная кислота, в концентрации 1 моль имеет pH, равный нулю. Раствор сильной щелочи, такой как гидроксид натрия, в концентрации 1 моль имеет pH 14. Таким образом, измеренные значения pH будут лежать в основном в диапазоне от 0 до 14, хотя отрицательные значения pH и значения выше 14 вполне возможны.
Многое зависит от кислотности среды раствора. Поскольку pH представляет собой логарифмическую шкалу, разница в одну единицу pH эквивалентна десятикратной разнице в концентрации ионов водорода. Нейтральность PH не совсем достигает 7 (при 25 °C), хотя в большинстве случаев это хорошее приближение. Нейтральность определяется как условие, в котором [H+] = [OH-]. Поскольку самоионизация воды удерживает произведение этих концентраций [H+] × [OH-] = Kw, можно видеть, что при нейтральности [H+] = [OH−] = √Kw или pH = pKw / 2.
 Вам будет интересно:«Исподний» — это про вещи, которым лучше остаться скрытыми
Вам будет интересно:«Исподний» — это про вещи, которым лучше остаться скрытыми
PKw составляет приблизительно 14, но зависит от ионной силы и температуры, поэтому также имеет значение кислотности среды ph, которое должно быть на нейтральном уровне. Чистая вода и раствор NaCl в чистой воде являются нейтральными, так как диссоциация воды производит одинаковое количество обоих ионов. Однако pH нейтрального раствора NaCl будет немного отличаться от pH нейтральной чистой воды, поскольку активность ионов водорода и гидроксида зависит от ионной силы, поэтому Kw изменяется в зависимости от ионной силы.
Растения
Зависимые растительные пигменты, которые можно использовать в качестве индикаторов pH, встречаются во многих растениях, включая гибискус, краснокочанную капусту (антоцианин) и красное вино. Сок цитрусовых является кислым, потому что он содержит лимонную кислоту. Другие карбоновые кислоты встречаются во многих живых системах. Например, молочная кислота вырабатывается мышечной активностью. Состояние протонирования производных фосфатов, таких как АТФ, зависит от кислотности среды pH. На функционирование фермента переноса кислорода гемоглобина влияет pH в процессе, известном как эффект корня.
Морская вода
В морской воде pH обычно ограничен диапазоном от 7,5 до 8,4. Он играет важную роль в круговороте углерода в океане, и есть свидетельства постоянного подкисления океана, вызванного выбросами углекислого газа. Однако измерение pH осложняется химическими свойствами морской воды, и в химической океанографии существует несколько различных шкал pH.
Особые растворы
В рамках оперативного определения шкалы кислотности среды (pH) IUPAC определяет серию буферных растворов в диапазоне значений pH (часто обозначается NBS или NIST). Эти растворы имеют относительно низкую ионную силу (≈0,1) по сравнению с морской водой (≈0,7) и, как следствие, не рекомендуются для использования при характеристике pH морской воды, поскольку различия в ионной силе вызывают изменения потенциала электрода. Чтобы решить эту проблему, была разработана альтернативная серия буферов на основе искусственной морской воды.
Эта новая серия решает проблему различий ионной силы между образцами и буферами, а новая шкала рН кислотности среды называется общей шкалой, часто обозначаемой как рНТ. Общий масштаб определялся с использованием среды, содержащей сульфат-ионы. Эти ионы испытывают протонирование, H+ + SO2-4 ⇌ HSO-4, так что общий масштаб включает в себя влияние как протонов (свободных ионов водорода), так и ионов сероводорода:
[H+] T = [H+] F + [HSO-4].
Альтернативная свободная шкала, часто обозначаемая как pHF, опускает это соображение и фокусируется исключительно на [H+] F, в принципе делая ее более простым представлением концентрации ионов водорода. Можно определить только [H+] T, поэтому следует оценивать [H+] F с использованием [SO2-4] и константой устойчивости HSO-4, К * S:
[H +] F = [H+] T - [HSO-4] = [H+] T (1 + [SO2-4] / К *S) -1.
Однако сложно оценить K * S в морской воде, ограничивая полезность более простой свободной шкалы.
Другая шкала, известная как шкала морской воды, часто называемая pHSWS, учитывает дальнейшую протонную связь между ионами водорода и фторид-ионами, H+ + F- ⇌ HF. В результате получается следующее выражение для [H+] SWS:
[H+] SWS = [H+] F + [HSO-4] + [HF]
Однако преимущество рассмотрения этой дополнительной сложности зависит от содержания фтора в среде. Например, в морской воде сульфат-ионы встречаются в гораздо более высоких концентрациях (> 400 раз), чем концентрации фтора. Как следствие, для большинства практических целей разница между общей шкалой и шкалой морской воды очень мала.
Следующие три уравнения суммируют три шкалы pH:
pHF = - log [H+] FpHT = - log ([H+] F + [HSO-4]) = - log [H+] TpHSWS = - log ([H+] F + [HSO-4] + [HF]) = - log [H+]
С практической точки зрения три шкалы pH кислотной среды (или морской воды) различаются по своим значениям до 0,12 единиц pH, причем различия намного больше, чем обычно требуется для точности измерений pH, в частности, в отношении карбонатной системы океана.