Физику строения вещества впервые серьезно начал изучать Джозеф Дж. Томсон. Однако многие вопросы оставались у него без ответа. Спустя некоторое время Э. Резерфорд смог сформулировать модель строения атома. В статье мы рассмотрим опыт, который привел его к открытию. Т. к. на уроках физики строение вещества — это одна из самых интересных тем, мы разберем ее ключевые аспекты. Узнаем, из чего состоит атом, научимся находить количество электронов, протонов, нейтронов в нем. Познакомимся с понятием изотопов и ионов.
Открытие электрона
 Вам будет интересно:Значения слова "бар" в топонимике, науке и других сферах
Вам будет интересно:Значения слова "бар" в топонимике, науке и других сферах
В 1897 г. английский ученый Джозеф Джон Томсон (его портрет можно увидеть ниже) изучал электрический ток, т. е. направленное движение зарядов в газах. В то время о молекулярном строении вещества физика уже знала. Было известно, что все тела состоят из материи, которая состоит из молекул, а последние — из атомов.

Томсон обнаружил, что при определенных условиях атомы газа испускают частицы с отрицательным зарядом (qэл <0). Они получили название электронов. Атом нейтрален, значит, если электроны вылетают из него, то там должны содержаться и положительные частицы. Что же собой представляет часть атома со знаком "+"? Как она взаимодействует с отрицательно заряженным электроном? Что определяет массу атома? Ответить на все эти вопросы смог другой ученый.
Опыт Резерфорда
Первоначальными сведениями о строении вещества физика в 1911 г. уже владела. Эрнест Резерфорд обнаружил то, что мы сегодня называем атомным ядром.

Существуют материи, обладающие странным свойством: они самопроизвольно испускают различные частицы, как положительные, так и отрицательные. Такие вещества получили название радиоактивных. Положительно заряженные элементы Резерфорд назвал альфа-частицами (α-частицами).
Они имеют заряд со знаком "+", равный двум элементарным (qα = +2e). Вес элементов приблизительно равен четырем массам атома водорода. Резерфорд взял радиоактивный препарат, который испускает альфа-частицы, и их потоком бомбардировал тонкую пленку золота (фольгу).
Он обнаружил, что большинство α-элементов почти не изменяют своего направления, проходя через атомы металла. Но существует очень небольшое количество тех, которые отклоняются назад. Почему так происходит? Зная физику строения вещества, можно ответить: потому что внутри атомов золота, как и любых других, существуют положительные элементы, которые отталкивают альфа-частицы. Но почему это происходит только с очень небольшим количеством элементов? Потому что размеры положительно заряженной части атома гораздо меньше его самого. К этому выводу и пришел Резерфорд. Положительно заряженную часть атома он назвал ядром.
Устройство атома
Физика строения вещества: молекулы состоят из атомов, которые содержат крошечную положительно заряженную часть (ядро), окруженную электронами. Нейтральность атома объясняется тем, что суммарный отрицательный заряд электронов равняется положительному - ядра. qядра + qэл=0. Почему же электроны не падают на ядро, ведь они же притягиваются? Чтобы ответить на этот вопрос, Резерфорд предположил, что они вращаются, как планеты движутся вокруг Солнца и не сталкиваются с ним. Именно движение позволяет этой системе быть стабильной. Модель атома, придуманная Резерфордом, получила название планетарной.
Если атом нейтральный, а число электронов в нем обязательно должно быть целым, то заряд ядра равен этой величине со знаком плюс. qядра= +z * e. z — это число электронов в нейтральном атоме. В таком случае суммарный заряд равен нулю. Как узнать число электронов в атоме? Нужно воспользоваться периодической системой элементов. Размеры атома имеют порядок 10-10 м. А ядра в 100 тысяч раз меньше — 10-15 м.
Представим, что мы увеличили размеры ядра до 1 метра. В твердом теле расстояние между атомами примерно равно величине их самих, значит, размеры увеличатся до 105, а это 100 км. То есть атом практически состоит из пустоты, вот почему альфа-частицы в основном пролетают сквозь фольгу, почти не отклоняясь.
Строение ядра
Физика строения вещества такова, что ядро состоит из частиц двух сортов. Некоторые из них обладают положительным зарядом. Если мы рассматриваем атом, у которого три электрона, то внутри него — три частицы с положительным зарядом. Они называются протоны. Другие элементы не обладают электрическим зарядом — нейтроны.
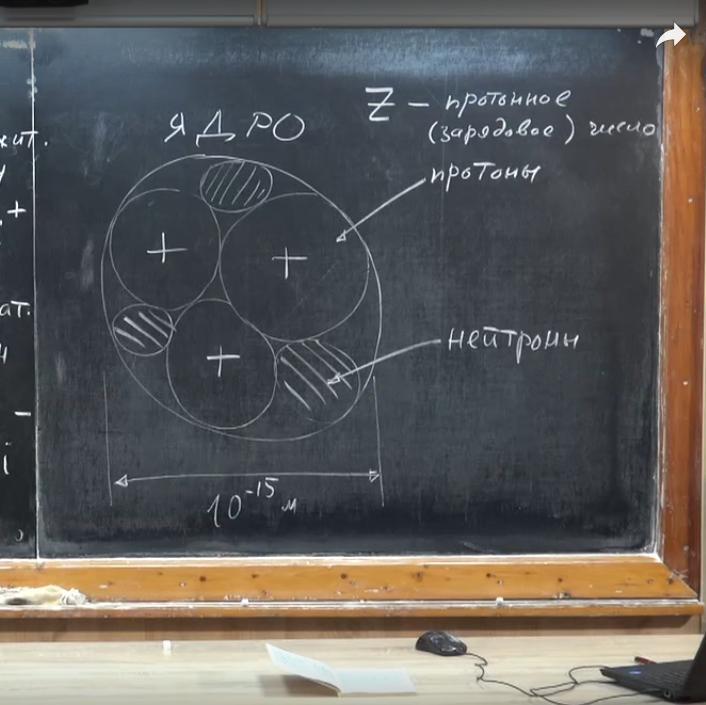
Массы протона и нейтрона приблизительно равны. И та, и другая частицы имеют вес, гораздо больший, чем электрон. mпротона ≈ 1837mэл. То же касается и массы нейтрона. Из этого следует вывод: вес положительно и нейтрально заряженных частиц — фактор, определяющий массу атома. У протонов и нейтронов есть общее название — нуклоны. Вес атома определяется их количеством, которое называется массовым числом ядра. Число электронов в атоме мы обозначили буквой z, но т. к. он нейтрален, то количество положительных и отрицательных частиц должно совпадать. Поэтому z еще называют протонным или зарядовым числом.
Если известны массовое и зарядовое число, то мы можем найти и количество нейтронов N. N = A - z. Как узнать, сколько нуклонов и протонов находится в ядре? Оказывается, в таблице Менделеева возле каждого элемента указано число, которое химики называют относительной атомной массой.

Если его округлить, получим не что иное, как массовое число или количество нуклонов в ядре (А). Порядковый номер элемента представляет собой количество протонов (z). Зная А и z, легко найти N — число нейтронов. Если атом нейтрален, то количество электронов и протонов равно.
Изотопы
Существуют разновидности ядра, в котором число протонов совпадает, а количество нейтронов может отличаться (имеется в виду один и тот же химический элемент). Их называются изотопами. В природе атомы разных сортов перемешались, поэтому химики измеряют усредненную массу. Именно поэтому в таблице Менделеева относительный вес атома — это всегда дробное число. Разберемся, что произойдет с нейтральным атомом, если убрать из него электрон или, наоборот, поместить лишний.
Ионы
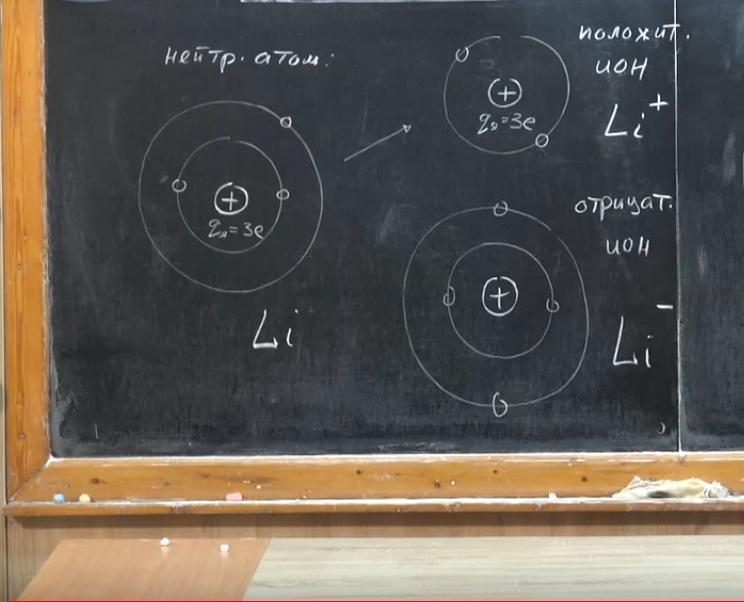
Рассмотрим нейтральный атом лития. Есть ядро, два электрона расположены на одной оболочке и три — на другой. Если мы заберем один из них, получится положительно заряженное ядро. qядра = 3е. Электроны компенсируют только два из трех элементарных зарядов, и мы получаем положительный ион. Он обозначается так: Li+. Ион — это атом, у которого количество электронов меньше или больше числа протонов в ядре. В первом случае - это положительный ион. Если мы добавим лишний электрон, то их будет уже четыре, и мы получим отрицательный ион (Li-). Такова физика строения вещества. Итак, нейтральный атом от иона отличается тем, что в нем электроны полностью компенсируют заряд ядра.
