Процессы сжатия, расширения, нагрева и охлаждения газообразных систем играют важную роль в технике и природе, поэтому понимание законов, описывающих переходы из одного термодинамического состояния в другое, является принципиальным. Удобнее всего эти законы изучать и использовать в графической форме. В данной статье рассмотрим графики изопроцессов в физике.
Что понимают под изопроцессами в газах?
Когда говорят, что изучаемая закрытая система перешла из термодинамического состояния 1 в состояние 2 в результате осуществления определенного изопроцесса, то имеют в виду квазистатический ее переход при определенном фиксированном термодинамическом параметре. Квазистатическим переход называется потому, что во время его осуществления система незначительно отклоняется от равновесного состояния, то есть сам процесс является медленным. В таком случае микроскопические характеристики успевают выровняться по всему объему, что позволяет определить в любой момент времени макроскопические параметры (давление P, объем V, температуру T).
 Вам будет интересно:Изопроцессы в физике: формулы и решение задач, основные понятия
Вам будет интересно:Изопроцессы в физике: формулы и решение задач, основные понятия
Ниже будут рассмотрены три наиболее важных изопроцесса и графики, которые им соответствуют.
Изопроцесс при неизменной абсолютной температуре
Он также называется изотермическим. Математически его описывают законом Бойля-Мариотта:
P*V = const.
Где значение константы зависит от количества вещества в системе и от ее температуры.
Если построить для этого изопроцесса график в координатах P-V, то мы получим показанную ниже гиперболу, которая приближается к осям давления и объема.
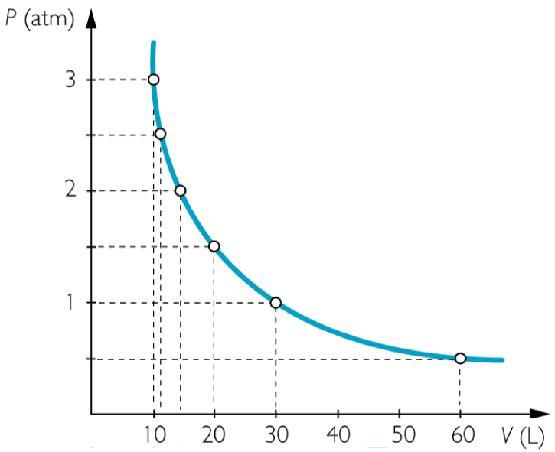
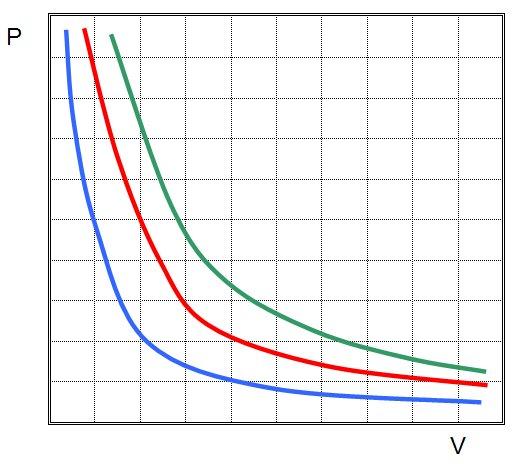
Как видно, каждому объему соответствует одно единственное давление в изучаемой системе. Если начинать увеличивать или уменьшать температуру, то изотерма будет отдаляться от осей или приближаться к ним. На графике ниже системе с наибольшей температурой соответствует зеленая гипербола.
В некоторых случаях бывает удобным представить изотерму в координатных осях P-1/V. Удобство заключается в том, что график будет представлять прямую линию.
Изопроцесс при постоянном давлении
Он называется изобарным переходом. На практике его легко получить, если нагревать любой газ в цилиндре с подвижным поршнем. В результате нагрева система увеличивает свой объем и температуру, сохраняя неизменным давление.
Формула для изобарного процесса носит название закона Шарля и выглядит следующим образом:
V/T = const.
Постоянная в правой части равенства однозначно определяется, если известны число молекул или атомов в системе и давление.
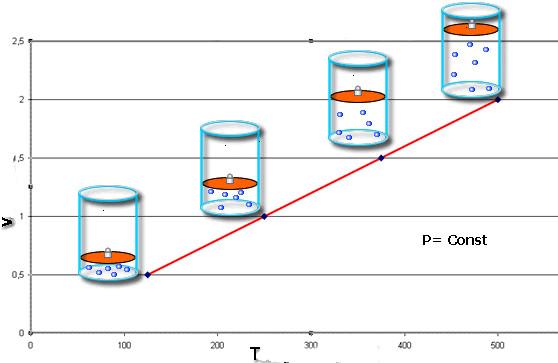
Закон Шарля устанавливает прямую пропорциональность между температурой и объемом с положительным углом наклона, поэтому для изучаемого изопроцесса график представляет собой прямую линию. В качестве примера ниже приведена произвольная изобара.
Нагрев и охлаждение при постоянном объеме
Обозначенный в названии этого пункта процесс является изохорным. Объем в таком случае оказывается фиксированным, изменяются лишь давление и температура. Изменения этих величин рассчитываются с помощью следующего выражения:
P/T = const.
Постоянная const зависит от объема системы и количества вещества в нем. Выражение называется законом Гей-Люссака. Соответствующий ему график в осях P-T представляет собой возрастающую линейную зависимость (см. главное фото). Увеличение объема системы при сохранении числа частиц в ней приводит к приближению к оси температур изохоры.
Приведенные в статье формулы и графики изопроцессов справедливы только в том случае, если изучаемая система с хорошей точностью описывается моделью идеального газа. Если это не так, то представленные графические зависимости будут искажаться, и их следует перестраивать с использованием модели Ван-дер-Ваальса для реальных газов.