Газовое состояние окружающей нас материи представляет собой одну из трех распространенных форм вещества. Указанное текучее агрегатное состояние в физике принято рассматривать в приближении идеального газа. Используя это приближение, опишем в статье возможные изопроцессы в газах.
Идеальный газ и универсальное уравнение для его описания
Идеальным называют такой газ, частицы которого не имеют размеров и не взаимодействуют друг с другом. Очевидно, что не существует ни одного газа, который бы точно удовлетворял этим условиям, поскольку даже самый маленький атом – водород, обладает определенными размерами. Более того, даже между нейтральными атомами благородных газов существует слабое ван-дер-ваальсовое взаимодействие. Тогда встает вопрос: в каких случаях можно пренебречь размерами газовых частиц и взаимодействием между ними? Ответом на этот вопрос будет соблюдение следующих физико-химических условий:
- низкое давление (порядка 1 атмосферы и ниже);
- высокие температуры (около комнатной и выше);
- химическая инертность молекул и атомов газа.
 Вам будет интересно:Вандербильт Консуэло: история герцогини, биография, фото
Вам будет интересно:Вандербильт Консуэло: история герцогини, биография, фото
Если хотя бы одно из условий не соблюдается, то газ следует считать реальным и описывать его специальным уравнением Ван-дер-Ваальса.
Уравнение Менделеева-Клапейрона необходимо рассмотреть перед изучением изопроцессов. Уравнение идеального газа – его второе название. Оно имеет следующую форму записи:
P*V = n*R*T
То есть оно связывает три термодинамических параметра: давление P, температуру T и объем V, а также количество n вещества. Символом R здесь обозначена газовая постоянная величина, она равна 8,314 Дж / (К * моль).
Что такое изопроцессы в газах?
Под этими процессами понимают переходы между двумя разными состояниями газа (начальным и конечным), в результате которых сохраняются одни величины и изменяются другие. Выделяют три типа изопроцесса в газах:
- изотермический;
- изобарный;
- изохорный.

Важно отметить, что все они были экспериментально изучены и описаны в период со второй половины XVII века и до 30-х годов XIX века. На основании этих экспериментальных результатов Эмиль Клапейрон в 1834 году получил уравнение, универсальное для газов. Данная же статья построена наоборот - применяя уравнение состояния, получим формулы для изопроцессов в идеальных газах.
Переход при постоянной температуре
Он называется изотермическим процессом. Из уравнения состояния идеального газа следует, что при постоянной абсолютной температуре в закрытой системе должно оставаться постоянным произведение объема на давление, то есть:
P*V = const
Эту зависимость действительно наблюдали Роберт Бойль и Эдм Мариотт во второй половине XVII века, поэтому в настоящее время записанное равенство носит их фамилии.
Функциональные зависимости P(V) или V(P), выраженные графически, имеют вид гипербол. Чем выше температура, при которой проводят изотермический эксперимент, тем больше произведение P*V.
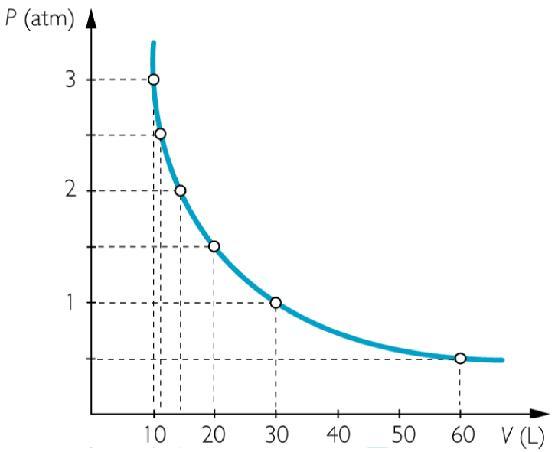
При изотермическом процессе газ расширяется или сжимается, совершая работу и не изменяя своей внутренней энергии.
Переход при постоянном давлении
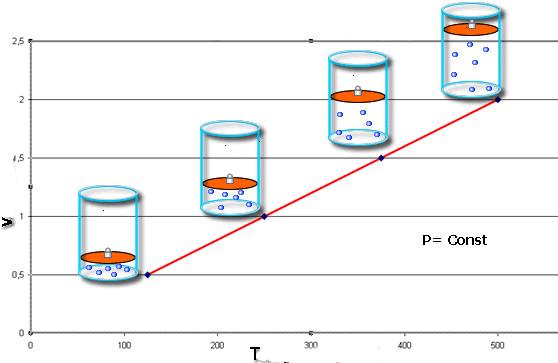
Теперь изучим изобарный процесс, во время которого давление поддерживается постоянным. Примером такого перехода является нагрев газа, находящегося под поршнем. В результате нагрева увеличивается кинетическая энергия частиц, они начинают чаще и с большей силой ударять по поршню, в результате чего газ расширяется. В процессе расширения газ выполняет некоторую работу, КПД которой составляет 40 % (для одноатомного газа).
Для этого изопроцесса уравнение состояния газа идеального говорит о том, что должно выполняться следующее соотношение:
V/T = const
Получить его легко, если постоянное давление перенести в правую часть уравнения Клапейрона, а температуру – в левую. Это равенство называется законом Шарля.
Равенство свидетельствует о том, что функции V(T) и T(V) имеют вид прямых линий на графиках. Наклон линии V(T) относительно оси абсцисс будет тем меньше, чем больше величина давления P.
Переход при неизменном объеме
Последним изопроцессом в газах, который мы рассмотрим в статье, является изохорный переход. Используя универсальное уравнение Клапейрона, несложно получить следующее равенство для этого перехода:
P/T = const
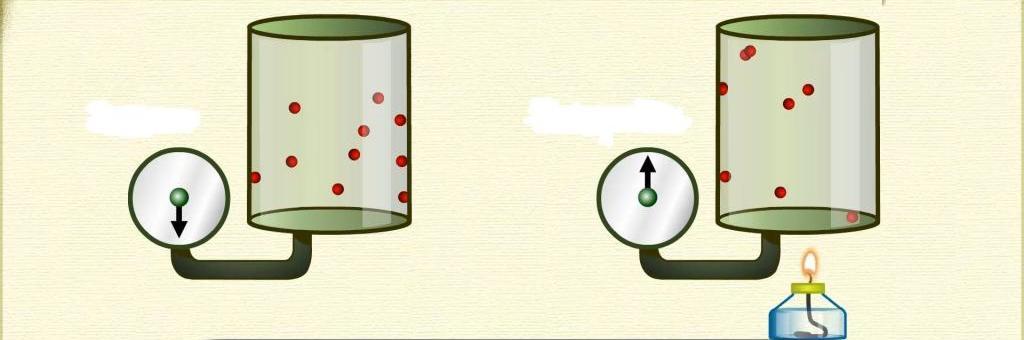
Изохорный переход описывается законом Гей - Люссака. Видно, что графически функции P(T) и T(P) будут представлять собой прямые линии. Среди всех трех изопроцессов, изохорный является самым эффективным, если необходимо повысить температуру системы за счет подвода внешнего тепла. Во время этого процесса газ не совершает работы, то есть все тепло будет направлено на увеличение внутренней энергии системы.