Строение веществ было интересно людям с той поры, как возникла возможность не беспокоиться о пропитании и изучать окружающий мир. Такие явления, как засухи, наводнения, молнии, ужасали человечество. Незнание их объяснений порождало веру в различных злых богов, требующих жертв. Именно поэтому люди начали изучать природные явления, стремясь к их предсказанию, и углубляться в строение веществ. Они изучили строение атома и ввели следующие два важных понятия в химии: энергетический уровень и подуровень.
Предпосылки к открытию мельчайших химических веществ
 Вам будет интересно:Что такое холод? Прямое и переносное значение слова, интересные факты
Вам будет интересно:Что такое холод? Прямое и переносное значение слова, интересные факты
О маленьких частицах, из которых состоят вещества, догадались еще древние греки. Они сделали странное открытие: мраморные ступени, по которым за несколько десятилетий прошло множество людей, изменили свою форму! Это привело к выводу о том, что ступня прошедшего забирает какую-то частичку камня с собой. Данное явление далеко от понимания существования энергетического уровня в химии, но именно с него все началось. Наука начала прогрессивно развиваться и углубляться в строение химических элементов и их соединений.
Начало изучения строения атома
В начале XX века посредством опытов с электричеством был открыт атом. Он считался электронейтральным, но имел положительные и отрицательные составные частицы. Ученые хотели выяснить их распределение внутри атома. Было предложено несколько моделей, одна из которых даже имела название «булочка с изюмом». Британский физик Эрнест Резерфорд провел опыт, который показал, что в центре атома расположено положительное ядро, а отрицательный заряд находится в маленьких электронах, вращающихся вокруг него.
Открытие энергетического уровня в химии стало большим прорывом в изучении строения веществ и явлений.
Энергетический уровень
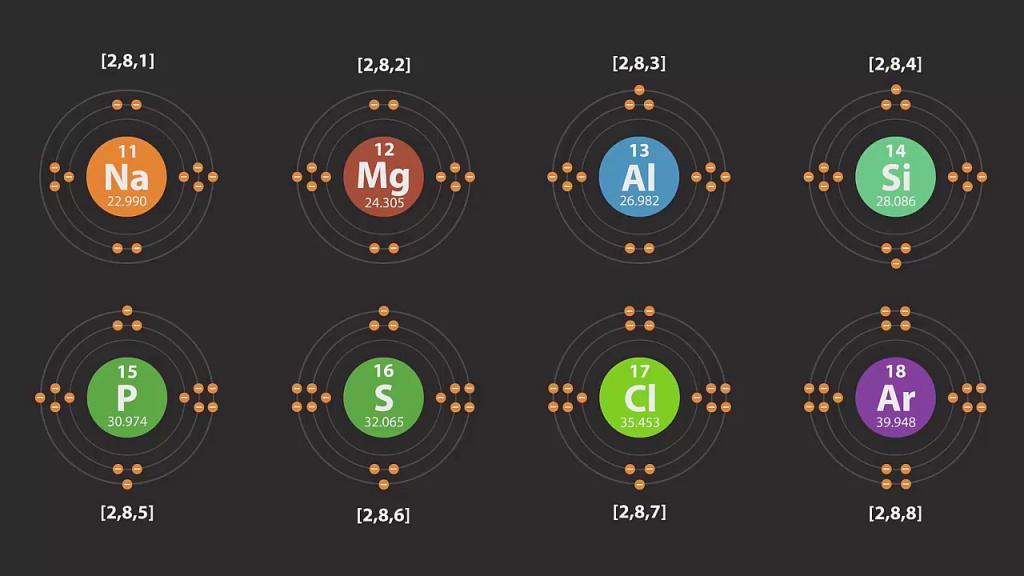
В ходе изучения свойств химических веществ выяснилось, что каждый элемент имеет свои уровни. Например, у кислорода схема строения одна, а у азота совсем другая, хотя номера их атомов различны лишь на единицу. Так что такое энергетический уровень? Это электронные слои, состоящие из электронов, которые образуются по причине различной силы их притяжения к ядру атома. Одни находятся ближе, а другие - дальше. То есть верхние электроны «давят» на нижние.
Число энергетических уровней в химии равняется номеру периода в Периодической таблице Д. И. Менделеева. Наибольшее количество электронов, которые находятся на данном энергетическом уровне, определяется по следующей формуле: 2n2, где n - это номер уровня. Таким образом, на первом энергетическом уровне может быть расположено не более двух электронов, на втором - не более восьми, на третьем - восемнадцати и так далее.
У каждого атома есть уровень, находящийся от его ядра дальше других. Он является крайним, или последним, и называется внешним энергетическим уровнем. Число электронов на нем для элементов главных подгрупп равняется номеру группы.
Для построения схемы атома и его энергетических уровней в химии нужно следовать такому плану:
- определите число всех электронов атома данного элемента, которое равно его порядковому номеру;
- определите число энергетических уровней по номеру периода;
- определите число электронов на каждом энергетическом уровне.
Примеры схем строения энергетических уровней некоторых элементов смотрите ниже.
Энергетические подуровни
В атомах, помимо энергетических уровней, существуют еще и подуровни. На каждом уровне, в зависимости от числа электронов на нем, заполняются определенные подуровни. От того, как подуровень заполняется, различают четыре типа элементов:
- S-элементы. Происходит заполнение s-подуровней, на которых могут находиться не более двух электронов. К ним относятся первые два элемента от каждого периода;
- P-элементы. В данных элементах может быть не более шести электронов, расположенных на p-подуровне;
- D-элементы. К ним относятся элементы больших периодов (декад), находящиеся между s- и p-элементами;
- F-элементы. Заполнение f-подуровня происходит у актиноидов и лантоноидов, находящихся в шестом и седьмом периодах.