Трифторид хлора – соединение, которое характеризуется крайне сильной химической активностью. Под его воздействием происходит окисление практически всех веществ, включая стекло. Трифторид хлора токсичен и оказывает разрушающее влияние на живые организмы. Одним из интересных фактов, связанных с этим соединением, является то, что в фашистской Германии его планировали использовать как оружие. В США в 1943 г. предпринимались также попытки его применения в качестве топлива для быстроходных подводных лодок, но они закончились неудачей.
Описание
 Вам будет интересно:Эргатическая система: основы, термины и понятия, цели и функции
Вам будет интересно:Эргатическая система: основы, термины и понятия, цели и функции
Трифторид хлора, формула которого ClF3, – бесцветный газ с сильным запахом. При его попадании на органические и неорганические вещества во многих случаях происходит их самовоспламенение (даже тех, которые отличаются огнестойкостью, например асбест), так как он является сильнейшим окислителем. В связи с этим длительное время было затруднено получение ClF3 и его хранение.
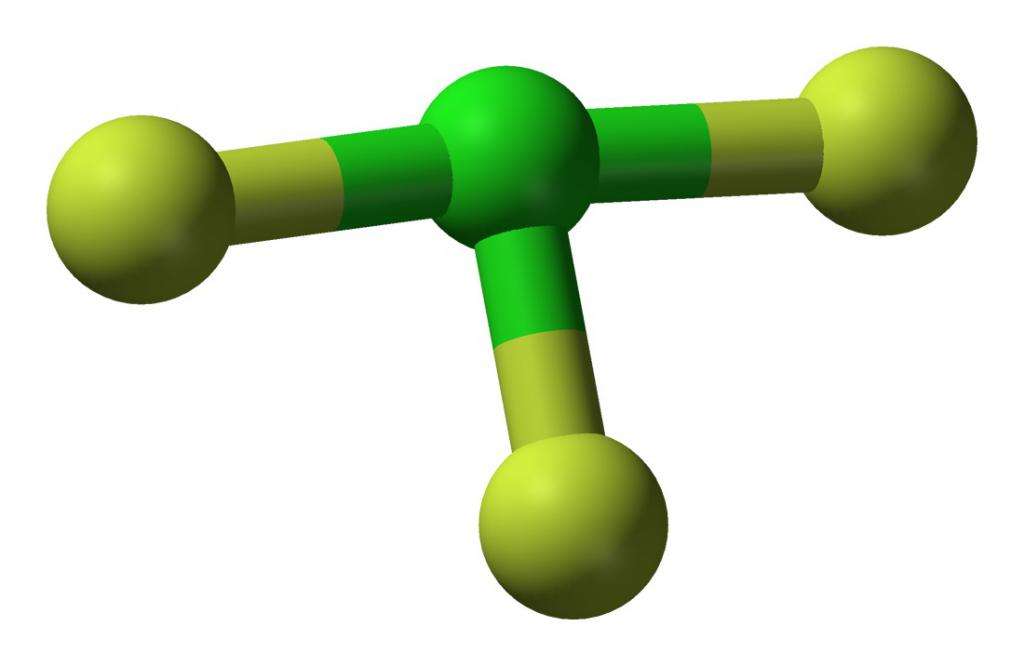
Газ можно сконденсировать и держать длительное время в специальных баллонах. Конденсирование происходит при температуре 285 °К или при повышении давления. В таком состоянии это вещество выглядит как жидкость зеленоватого цвета. В статье приведено фото трифторида хлора, отражающее его структуру. Изучение инфракрасного спектра поглощения позволило сделать вывод о том, что данное соединение имеет Т-образную структуру молекул.
Физико-химические свойства
Основными характеристиками трифторида хлора являются:
- температура плавления – 196 °К;
- температура кипения – 284 °К;
- молекулярный вес при нормальный условиях – 92,457 г/моль;
- электропроводность при 25 °С – 3,1×10-9 Ом-1∙см-1;
- содержание фтора – 61 %;
- плотность при 25 °С – 1,8 г/см3.
Это вещество является наиболее реакционноспособным из всех галогенофторидов и сильным окислителем. Может бурно реагировать даже с водой. С некоторыми соединениями реакция взаимодействия протекает со взрывом.

ClF3 в газообразном состоянии при его облучении положительно заряженными альфа-частицами разлагается. Продуктами распада являются монофторид хлора и фтор.
Реагирование с органическими веществами происходит с самовоспламенением, поэтому их фторирование практически не поддается контролю.
Получение
Впервые это соединение было синтезировано в 1930 г. Очищенные фтор и хлор подавались в нагретый реактор из меди. В нем происходило образование моно- и трифторида хлора, который конденсировался в первом приемнике при -70 °С, во втором приемнике улавливался ClF (при t= -150 °С), а в третьем был жидкий воздух для вымораживания излишка фтора. К последнему приемнику присоединялась трубка, заполненная прокаленным KF, который служил для защиты от атмосферной влаги.

Так как это вещество очень активно в химическом отношении, то при его синтезе можно применять аппаратуру, сделанную из меди (устойчива до температуры 400 °С), никеля (до 750 °С) и их сплавов (монель). Это объясняется образованием защитной фторидной пленки на их поверхности. В лабораторных условиях используют посуду из фторопласта или монель-металла, так как данное соединение способно воспламенять стекло.
Применение
Трифторид хлора способен взаимодействовать со всеми элементами, кроме платины, кислорода и азота. Поэтому данное вещество рассматривается, прежде всего, в качестве фторирующего агента для производства различных соединений, содержащих фтор.
Смесь пентаборана и трифторида хлора представляет определенный интерес для применения в качестве ракетного топлива. Во времена Второй мировой войны нацистские ученые проводили исследования, изучая возможность использования этого вещества в качестве дешевого химического оружия и сырья для огнеметов и бомб. Ими было изготовлено около 30 т трифторида хлора, но его не использовали. В настоящее время данное соединение подпадает под действие Конвенции о запрещении химического оружия.

За рубежом трифторид хлора используют также для повышения температуры пламени при сварке и резании металлов (в качестве добавки к сварочному газу). Проводятся исследования о возможности применения ClF3 для регенерации ядерного горючего.
В связи с трудностью осуществления экспериментальных работ данное вещество еще недостаточно изучено, особенно это касается его химических свойств. Фторидсодержащие материалы в настоящее время находят широкое применение в качестве флюсов при выплавке стали, сварке, пайке, а также в электронике и лазерной технике.
Влияние на организм человека
Трифторид хлора – это очень токсичное соединение. Помимо ожогов, которые оно вызывает ввиду своей повышенной окислительной способности, ClF3 оказывает удушающее действие и поражает легкие.
В процессе реагирования с окружающей средой трифторид хлора образует пары плавиковой кислоты, которые приводят к острым и хроническим отравлениям. Кислота относится ко 2-му классу опасности, как и исходное вещество. Максимальное ПДК трифторида хлора в воздухе – 0,4 мг/м3. Попытки нейтрализации пламени водой вызывают взрывную реакцию.