Все белки нашего организма построены из аминокислот. Белков в организме огромное множество, а кирпичиков — аминокислот, из которых они состоят, всего 20. Таким образом, белки отличаются друг от друга набором аминокислот и их последовательностью. Цистеин является одной из этих 20 аминокислот.
Цистеин — что это такое?
Цистеин — алифатическая серосодержащая аминокислота. Алифатическая — содержащая только насыщенные связи. Как и у любой аминокислоты, формула цистеина включает карбоксильную (-СООН) и аминогруппу (-NH2), а также уникальную тиоловую (-SH). В состав тиоловой (другое название — сульфгидрильной) группы входит атом серы и атом водорода.
 Вам будет интересно:Физический смысл момента инерции: аналогия с линейным движением, примеры
Вам будет интересно:Физический смысл момента инерции: аналогия с линейным движением, примеры
Молекулярная химическая формула цистеина — С3Н7NO2S. Молекулярная масса — 121.
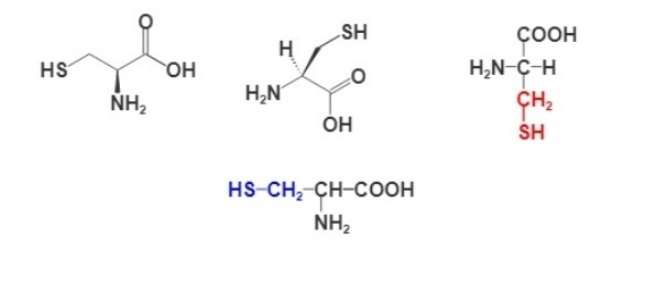
Формула аминокислоты цистеина
Для изображения строения аминокислот используют разные формулы. Ниже представлены несколько вариантов написания структурной формулы цистеина.
Все аминокислоты имеют амино- и карбоксильную группы, присоединенные к α-углеродному атому, и отличаются только строением радикала, присоединенному к этому же атому углерода. Например, ниже представлены структурные формулы аланина, цистеина и глицина, серина а также цистина.
 Вам будет интересно:Что это - нанометр? Сравнение с метром, понятие о нанотехнологиях, интересные факты
Вам будет интересно:Что это - нанометр? Сравнение с метром, понятие о нанотехнологиях, интересные факты
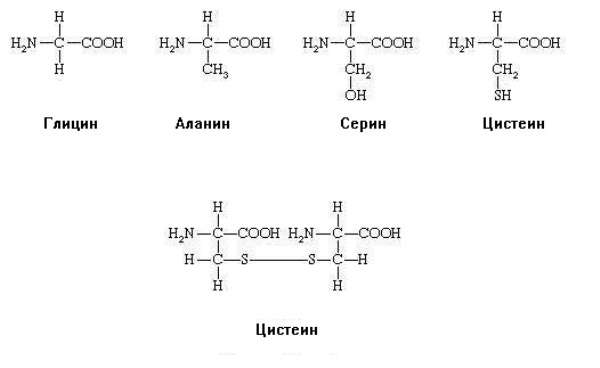
Все аминокислоты имеют одинаковый остов и разные радикалы. Именно строение радикала лежит в основе квалификации аминокислот и определяет свойства самой молекулы. У цистеина формула радикала — СН2-SH. Этот радикал относится к группе полярных незаряженных, гидрофильных. Это значит, что участки белка, содержащие цистеин, могут присоединять воду (гидратироваться) и взаимодействовать при помощи водородных связей с другими участками белка, также содержащими аминокислоты с гидрофильными группами.
Цистеин содержит уникальную тиоловую группу
Цистеин — уникальная аминокислота. Она единственная среди 20 природных аминокислот содержит тиоловую (-HS) группу. Тиоловые группы могут подвергаться окислительным и восстановительным реакциям. При окислении тиоловой группы цистеина образуется цистин — аминокислота, представляющая собой два цистеиновых остатка, соединенных дисульфидной связью. Реакция обратима — восстановление дисульфидной связи регенерирует две молекулы цистеина. Дисульфидные связи цистина имеют решающее значение для определения структур многих белков.
 Вам будет интересно:Культивирование клеток и тканей: особенности и интересные факты
Вам будет интересно:Культивирование клеток и тканей: особенности и интересные факты
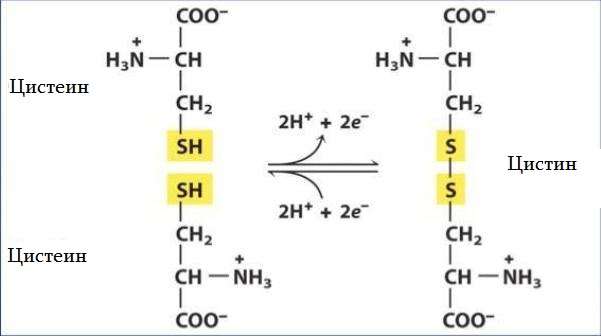
Окисление тиоловой группы цистеина приводит к образованию дисульфидной связи с другим тиолом, в ходе дальнейшего окисления образуются сульфиновые и сульфоновые кислоты.
Благодаря способности вступать в окислительно-восстановительные реакции, цистеин обладает антиоксидантными свойствами.
Цистеин — компонент белков
Аминокислоты, входящие в состав белков, называют протеиногенными. Как уже было сказано, их 20, и цистеин — один из них. Для формирования первичной структуры белка аминокислоты соединяются между собой в длинную цепь. Соединение идет за счет групп остова аминокислот, радикалы в этом не участвуют. Связь между аминокислотами образуется за счет карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты. Связь, образованная таким образом, между двумя аминокислотами, называется пептидной.
На рисунке представлена формула трипептида аланин цистеин фенилаланин и схема его образования.
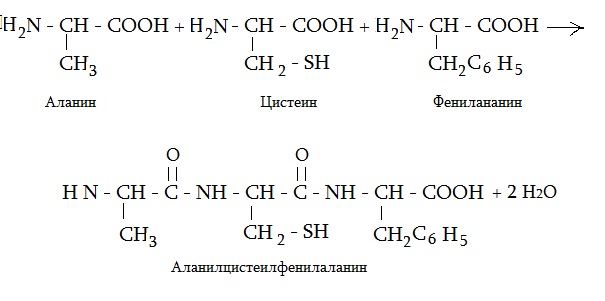
Самым мелким пептидом в организме является глутатион, в состав которого входят всего две аминокислоты, в том числе и цистеин. Две аминокислоты, соединенные между собой, называют дипептидом, три — трипептидом. Приведем еще формулу трипептида из аланина, лизина и цистеина.
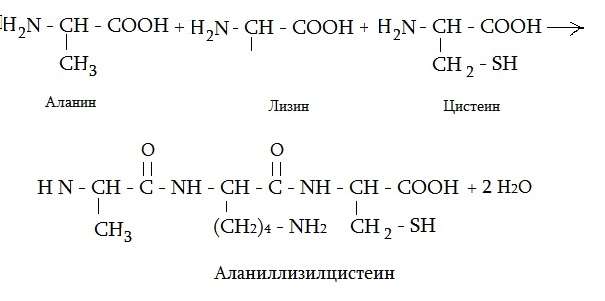
Вещества, содержащие от 10 до 40 аминокислот, называют полипептидами. В состав собственно белков входит более 40 аминокислотных остатков. Цистеин входит в состав многих пептидов и белков, например, инсулина.
Источники цистеина
Ежедневно человек должен потреблять 4,1 мг цистеина на 1 кг веса. То есть в организм человека с массой 70 кг должно поступать 287 мг этой аминокислоты в день.
Часть цистеина может синтезироваться в организме, часть поступает с пищей. Ниже приведен список продуктов, содержащих максимальное количество аминокислоты.
| Содержание цистеина в продуктах | |
| Продукт | Содержание цистеина в 100 г продукта, мг |
| Соевые продукты | 638 |
| Говядина и баранина | 460 |
| Семена (подсолнечника, арбуза, кунжута, льна, тыквы) и орехи (фисташки, кедровые) | 451 |
| Куриное мясо | 423 |
| Овес и овсяные отруби | 408 |
| Свинина | 388 |
| Рыба (тунец, лосось, окунь, скумбрия, палтус) и моллюски (мидии, креветки) | 335 |
| Сыр, молочные продукты и яйца | 292 |
| Бобовые (нут, бобы, фасоль, чечевица) | 127 |
| Крупы (гречка, ячмень, рис) | 120 |
Кроме того, цистеин содержится в красном перце, чесноке, луке, в темных листовых овощах — брюссельской капусте, брокколи.
Производят пищевые добавки, например, L-цистеин гидрохлорид, N-ацетилцистеин. Второй обладает большей растворимостью и легче усваивается организмом.
В промышленности L-цистеин получают гидролизом из перьев птиц, щетины и человеческих волос. Производится более дорогой синтетический L-цистеин, подходящий под мусульманские и еврейские пищевые правила (в соответствии с религиозными аспектами).
Синтез цистеина в организме
Цистеин, наряду с тирозином, относится к условно заменимым аминокислотам. Это значит, что они могут синтезироваться в организме, но только из незаменимых аминокислот: цистеин из метионина, тирозин из фенилаланина.
Для синтеза цистеина необходимы две аминокислоты — незаменимая метионин и заменимая серин. Метионин является донором атома серы. Цистеин синтезируется из гомоцистеина в ходе двух реакций, катализируемых пиридоксальфосфатом. Генетические нарушения, а также недостаток витаминов В9 (фолиевой кислоты), В6 и В12 приводят к нарушению использования фермента, гомоцистеин превращается не в цистеин, а в гомоцистин. Это вещество накапливается в организме, вызывая заболевание, сопровождающееся катарактой, остеопорозом, умственной отсталостью.
Синтез в организме может быть недостаточен у пожилых людей и младенцев, лиц с некоторыми метаболическими заболеваниями, страдающих синдромом мальабсорбции.
Реакции синтеза цистеина
В организме животного цистеин синтезируется непосредственно из серина, а источником серы является метионин. Метионин превращается в гомоцистеин через промежуточные вещества S-AM и S-АГ. S-аденозилметионин — активная форма метионина, образуется соединением АТФ и метионина. Выступает донором метильной группы в реакциях синтеза различных соединений: цистеина, адреналина, ацетилхолина, лецитина, карнитина.
В результате трансметилирования S-AM превращается в S-аденозилгомоцистеин (S-АГ). Последний в ходе гидролиза образует аденозин и гомоцистеин. Гомоцистеин соединяется с серином с участием фермента цистатионин-β-синтазы с образованием тиоэфирного цистатионина. Цистатионин превращается в цистеин и α-кетобутират под действием фермента цистатионин-γ-лиазы.
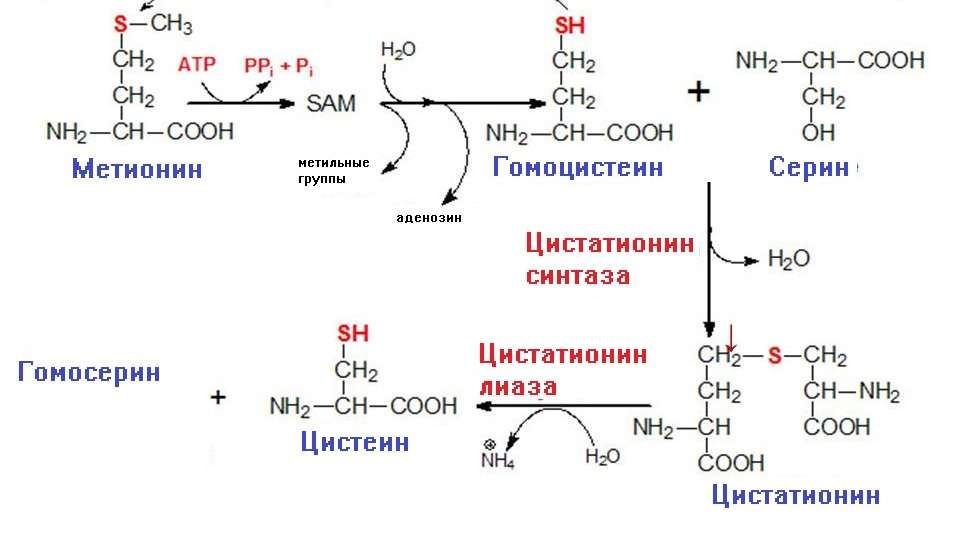
У растений и бактерий синтез происходит иначе. Источником серы для синтеза цистеина могут выступать разные вещества, даже сероводород.
Биологическая роль цистеина
За счет тиоловой группы (-HS) в составе формулы цистеина, в белках формируются дисульфидные связи, называемые дисульфидными мостиками. Дисульфидные связи — ковалентные, сильные. Они образуются между двумя молекулами цистеина в составе белка. Могут образовываться внутрицепочечные мостики в пределах одной полипептидной цепочки, и межцепочечные — между отдельными цепями белка. Например, в структуре инсулина имеют место оба вида мостиков. Эти связи обеспечивают поддержание третичной и четвертичной структуры белка.
Дисульфидные связи содержат в основном внеклеточные белки. Например, этот вид связи имеет большое значение в стабилизации структуры инсулина, иммуноглобулинов и пищеварительных ферментов. Белки, содержащие множество дисульфидных мостиков, более устойчивы к тепловой денатурации, что позволяет им поддерживать свою активность в более экстремальных условиях.
Особенности формулы цистеина обеспечивают ему антиоксидантные свойства. Цистеин играет роль антиоксиданта, вступая в реакции окисления-восстановления. Тиоловая группа имеет высокое сродство к тяжелым металлам, поэтому белки, содержащие цистеин, связывают металлы, такие как ртуть, свинец и кадмий. В составе белка рК цистеина такой, что это обеспечивает нахождение аминокислоты в реактивной тиолятной форме, то есть цистеин легко отдает HS-анион.
Цистеин является важным источником серы в метаболизме.
Функции цистеина
За счет наличия тиоловой группы, легко вступающей в реакции, цистеин участвует в разнообразных процессах в организме и выполняет многие функции.
Применение цистеина
Цистеин нашел широкое применение в медицинской, фармацевтической, пищевой промышленности.
Цистеин часто используют при лечении различных заболеваний:

Кроме того, цистеин ускоряет выздоровление после операций и ожогов, активизирует лейкоциты.
Цистеин ускоряет сжигание жиров и построение мышечной ткани, поэтому его часто применяют спортсмены.
Аминокислота применяется как ароматизатор. Цистеин является зарегистрированной пищевой добавкой Е920.
