- Понятие об электромагнитных спектрах
- Какие бывают электромагнитные спектры
- Линейчатые и непрерывные спектры излучения
- Линейчатый спектр поглощения
- Серии Бальмера, Лимана и Пашена
- Резерфорд, Бор и атомная модель
- Квантованность энергетических уровней
- Как изучают спектры в видимом диапазоне
- Оптика линзы и видимый спектр
Линейчатые спектры - это, пожалуй, одна из важных тем, которые рассматриваются в курсе физики 8 класса в разделе оптики. Важная она потому, что позволяет понять атомное строение, а также использовать эти знания для изучения нашей Вселенной. Рассмотрим в статье этот вопрос.
Понятие об электромагнитных спектрах
В первую очередь поясним, о чем пойдет речь в статье. Каждый знает, что видимый нами солнечный свет представляет собой электромагнитные волны. Любая волна характеризуется двумя важными параметрами - это ее длина и частота (третьим не менее важным ее свойством является амплитуда, отражающая интенсивность излучения).
 Вам будет интересно:Смертоносное древнерусское оружие шестопер: особенности, интересные факты и история
Вам будет интересно:Смертоносное древнерусское оружие шестопер: особенности, интересные факты и история
В случае электромагнитного излучения оба параметра связаны в следующее равенство: λ*ν = c, где греческими буквами λ (лямбда) и ν (ню) обычно обозначают длину волны и ее частоту, соответственно, а c - это скорость света. Поскольку последняя является величиной постоянной для вакуума, то длина и частота электромагнитных волн обратно пропорциональны друг другу.
 Вам будет интересно:Форсировать - это... Значения слова
Вам будет интересно:Форсировать - это... Значения слова
Электромагнитным спектром в физике принято называть совокупность различных длин волн (частот), которые испускаются соответствующим источником излучения. Если же вещество поглощает, а не излучает волны, тогда говорят о спектре адсорбции или поглощения.
Какие бывают электромагнитные спектры?
В общем случае существует два критерия их классификации:
Не будем в данной статье останавливаться на рассмотрении 1-го типа классификации. Здесь лишь кратко скажем, что существуют электромагнитные волны высоких частот, которые называются гамма-излучением (>1020 Гц) и рентгеновским (1018-1019 Гц). Ультрафиолетовый спектр представляет собой уже меньшие частоты (1015-1017 Гц). Видимый или оптический спектр лежит в области частот 1014 Гц, что соответствует набору длин от 400 мкм до 700 мкм (некоторые люди способны видеть немного "шире": от 380 мкм до 780 мкм). Более низкие частоты соответствуют инфракрасному или тепловому спектру, а также радиоволнам, которые уже в длину могут достигать несколько километров.
Далее в статье подробно рассмотрим 2-й тип классификации, который отмечен в списке выше.
Линейчатые и непрерывные спектры излучения
 Вам будет интересно:Полифосфат аммония: описание, свойства, применение
Вам будет интересно:Полифосфат аммония: описание, свойства, применение
Абсолютно любое вещество, если его нагреть, начнет испускать электромагнитные волны. Каких частот и длин волн они будут? Ответ на этот вопрос зависит от того, в каком агрегатном состоянии находится исследуемое вещество.
Жидкие и твердые тела излучают, как правило, непрерывный набор частот, то есть разница между ними настолько невелика, что можно вести речь о непрерывном спектре излучения. В свою очередь, если атомарный газ, имеющий невысокие давления, нагреть, то он начнет "светиться", испуская строго определенные длины волн. Если последние проявить на фотопленке, то они будут представлять собой узкие линии, каждая из которых отвечает за конкретную частоту (длину волны). Поэтому этот вид излучения был назван линейчатым спектром испускания.
Между линейчатым и непрерывным существует промежуточный тип спектра, который излучает обычно молекулярный, а не атомарный газ. Этот тип представляет собой изолированные полосы, каждая из которых, при ее детальном рассмотрении, состоит из отдельных узких линий.
Линейчатый спектр поглощения
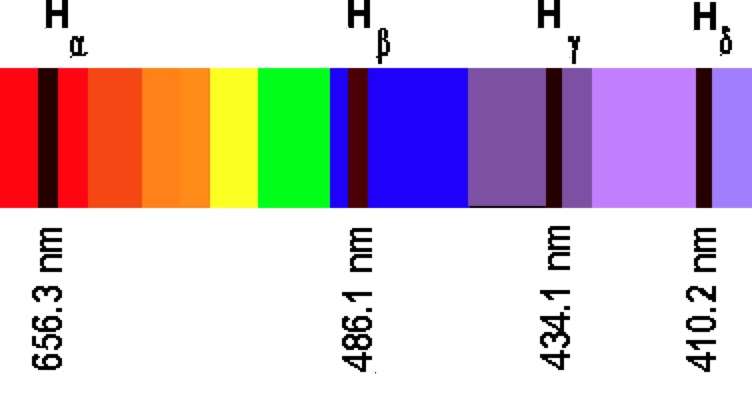
Все сказанное в предыдущем пункте относилось к излучению волн веществом. Но оно также обладает поглощательной способностью. Проведем обычный эксперимент: возьмем холодный разряженный атомарный газ (например, аргон или неон) и пропустим через него белый свет от лампы накаливания. После этого проанализируем прошедший через газ световой поток. Окажется, что если разложить этот поток на отдельные частоты (это можно сделать с помощью призмы), то в наблюдаемом непрерывном спектре появятся черные полосы, которые свидетельствуют, что эти частоты были поглощены газом. В этом случае говорят о линейчатом спектре поглощения.
В середине XIX в. немецкий ученый по имени Густав Кирхгоф открыл очень интересное свойство: он заметил, что места, в которых на сплошном спектре появляются черные линии, точно соответствуют частотам излучения данного вещества. В настоящее время названная особенность носит название закона Кирхгофа.
Серии Бальмера, Лимана и Пашена
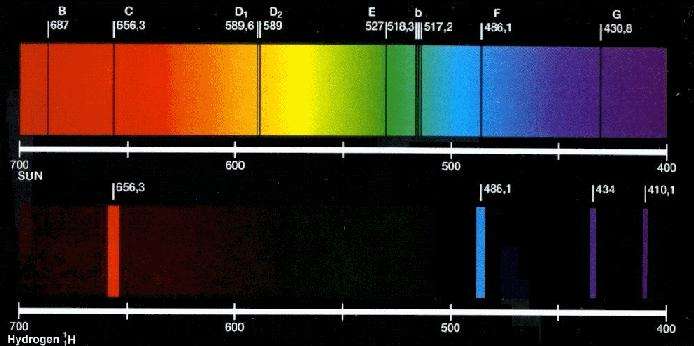
С конца XIX века физики всего мира стремились понять, что представляют собой линейчатые спектры излучения. Было установлено, что каждый атом данного химического элемента при любых условиях проявляет одинаковую излучательную способность, то есть испускает электромагнитные волны только конкретных частот.
Первые подробные исследования этого вопроса были проведены швейцарским физиком Бальмером. В своих экспериментах он использовал водородный газ, разогретый до высоких температур. Поскольку атом водорода является самым простым среди всех известных химических элементов, то на нем проще всего проводить изучение особенностей спектра излучения. Бальмер получил удивительный результат, который он записал в виде следующей формулы:
1/λ=RH*(1/4-1/n2).
Здесь λ - длина излучаемой волны, RH - некоторая постоянная величина, которая для водорода равна 1,097*107 м-1, n - целое число, начиная с 3-х, то есть 3, 4, 5 и т. д.
Все длины λ, которые получаются из этой формулы, лежат в пределах оптического спектра, видимого человеком. Эта серия значений λ для водорода получила название спектра Бальмера.
Впоследствии, используя соответствующее оборудование, американский ученый Теодор Лиман открыл ультрафиолетовый водородный спектр, который он описал формулой, подобной бальмеровской:
1/λ=RH*(1/1-1/n2).
Наконец, еще один немецкий физик, Фридрих Пашен, получил формулу для излучения водорода в инфракрасной области:
1/λ=RH*(1/9-1/n2).
Тем не менее только развитие квантовой механики в 20-е годы XX века смогло дать объяснение этим формулам.
Резерфорд, Бор и атомная модель
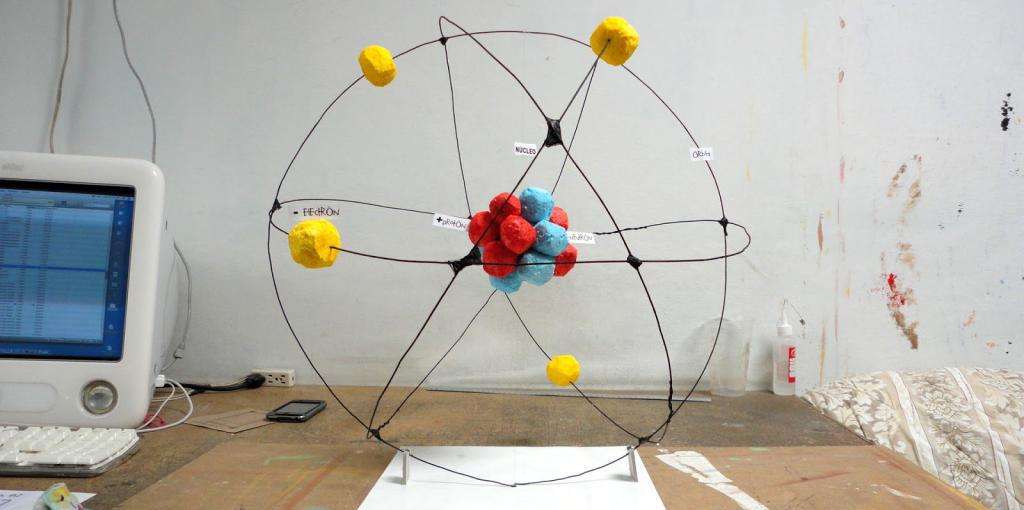
В первое десятилетие XX века Эрнест Резерфорд (британский физик новозеландского происхождения) провел множество экспериментов по изучению радиоактивности различных химических элементов. Благодаря этим исследованиям родилась первая модель атома. Резерфорд полагал, что эта "крупинка" материи состоит из ядра электрически положительного и вращающихся по его орбитам электронов отрицательных. Кулоновские силы объясняют, почему атом "не разваливается", а центробежные силы, действующие на электроны, являются причиной, почему последние не падают на ядро.
Все, казалось бы, логично в этой модели, за исключением одного но. Дело в том, что при движении по криволинейной траектории любая заряженная частица должна излучать электромагнитные волны. Но в случае стабильного атома этого эффекта не наблюдается. Тогда получается, что неверна сама модель?
Необходимые поправки в нее внес другой физик – датчанин Нильс Бор. Эти поправки в настоящее время известны как его постулаты. Бор ввел два положения в модель Резерфорда:
- электроны движутся по стационарным орбитам в атоме, при этом они не излучают и не поглощают фотоны;
- процесс излучения (поглощения) происходит только тогда, когда электрон переходит с одной орбиты на другую.
Что представляют собой стационарные боровские орбиты, рассмотрим в следующем пункте.
Квантованность энергетических уровней
Стационарные орбиты электрона в атоме, о которых впервые заговорил Бор, являются стабильными квантовыми состояниями этой частицы-волны. Эти состояния характеризуются определенной энергией. Последнее означает, что электрон в атоме находится в некоторой энергетической "яме". Попасть в другую "яму" он может, если получит извне дополнительную энергию в виде фотона.
В линейчатых спектрах поглощения и испускания для водорода, формулы которых приведены выше, можно увидеть, что первый член в скобках представляет собой некоторое число вида 1/m2, где m=1, 2, 3.. - целое число. Оно отражает номер стационарной орбиты, на которую переходит электрон с более высокого энергетического уровня n.
Как изучают спектры в видимом диапазоне?

Выше уже было сказано, что для этого используют стеклянные призмы. Впервые это сделал Исаак Ньютон в 1666 году, когда разложил видимый свет на набор цветов радуги. Причина, по которой наблюдается этот эффект, заключается в зависимости коэффициента преломления от длины волны. Так, синий цвет (короткие волны) преломляется сильнее, чем красный (длинные волны).
Отметим, что в общем случае при движении пучка электромагнитных волн в какой-либо материальной среде высокочастотные составляющие этого пучка всегда преломляются и рассеиваются сильнее, чем низкочастотные. Ярким примером является голубой цвет неба.
Оптика линзы и видимый спектр
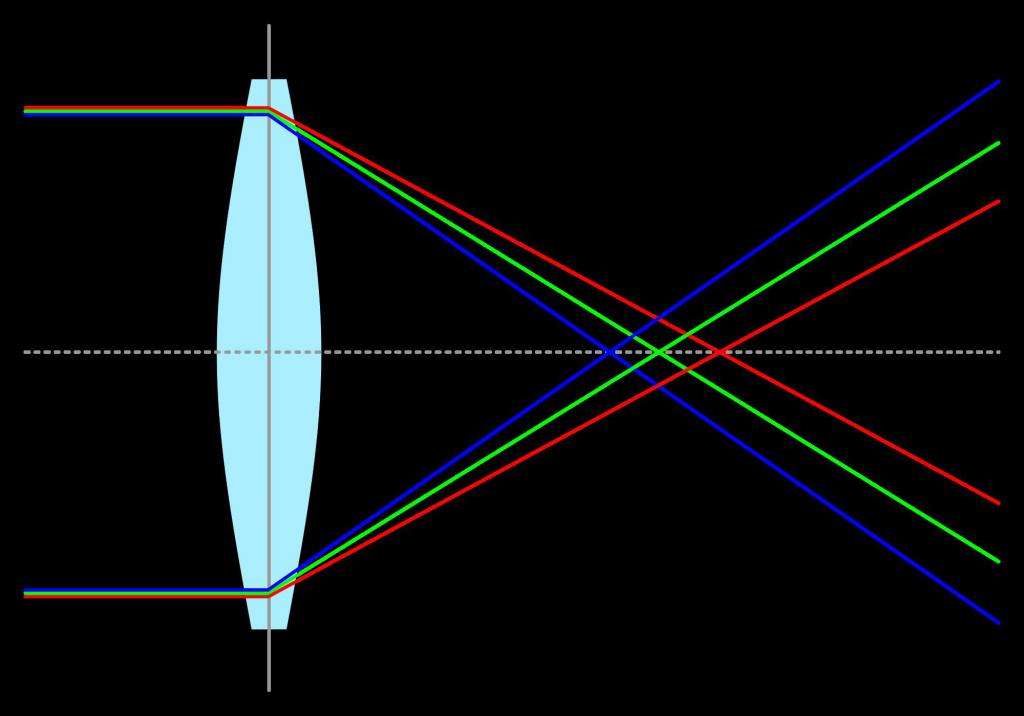
При работе с линзами часто используется солнечный свет. Поскольку он представляет собой непрерывный спектр, то при прохождении через линзу его частоты преломляются по-разному. В итоге оптический прибор оказывается неспособным собрать весь свет в одну точку, и появляются радужные оттенки. Этот эффект известен под названием хроматическая аберрация.
Указанная проблема оптики линзы частично решается с помощью комбинации оптических стекол в соответствующих приборах (микроскопах, телескопах).
