При изучении газового состояния вещества в современной физике используют сравнительно простую модель. Она базируется на принципах молекулярно-кинетической теории, предложенной в середине XVIII века Даниилом Бернулли. В рамках этой модели исследуется поведение систем во время разных преобразований. В данной статье приведем формулу закона Бойля-Мариотта и название изопроцесса, к которому он применим.
Модель идеального газа
Она основана на теории, которая полагает молекулы и атомы материальными точками, движущимися во всех направлениях с одинаковой скоростью. Кинетическая энергия частиц системы обуславливает наличие температуры в ней, а их постоянные столкновения со стенками сосуда приводят к возникновению давления. Считается, что в идеальной газовой модели частицы системы не взаимодействуют друг с другом, то есть их потенциальная энергия равна нулю.
 Вам будет интересно:Прекрасное - это ... Значение слова, синонимы и антонимы
Вам будет интересно:Прекрасное - это ... Значение слова, синонимы и антонимы
Поведение любого реального газа хорошо описывается этой теорией только в том случае, если он образован химически инертными молекулами или атомами, его давление является невысоким, а температура находится в пределах комнатной или превышает ее.
Закон Бойля-Мариотта: формула и формулировка

Во второй половине XVII века француз Эдм Мариотт и англичанин Роберт Бойль независимо друг от друга установили следующее соотношение между давлением P и объемом V газовой системы:
P*V = const.
Это равенство выполнялось с высокой точностью для всех исследуемых газов только в том случае, если поддерживалась постоянной температура t. В физике такой процесс называется изотермическим. Соответствующим графиком для него будет изотерма P(V).
Из формулы закона Бойля-Мариотта следует, что при изотермическом изменении одного равновесного состояния на другое давление в системе возрастает (уменьшается) ровно во столько раз, во сколько уменьшается (увеличивается) ее объем.
Хотя рассматриваемый закон был получен экспериментально, в настоящее время он может быть легко выведен из уравнения состояния идеального газа (закон Клапейрона-Менделеева), который имеет форму:
P*V = n*R*t.
Если рассматривается закрытая система (количество вещества n=const), то во время изотермического процесса в ней (t=const) правая часть равенства не будет изменяться, а значит, левая также будет оставаться постоянной, то есть мы приходим к формуле закона Бойля-Мариотта. Величина R здесь - это универсальная газовая константа.
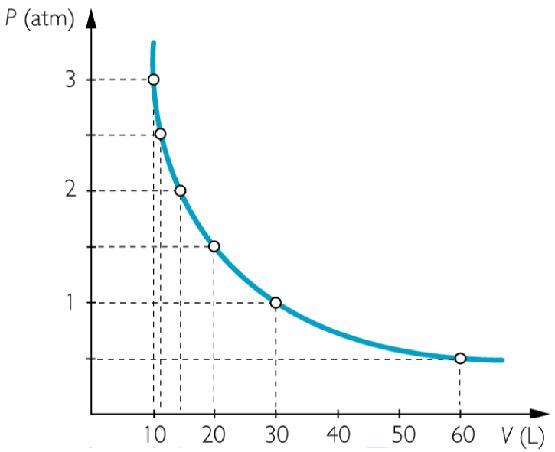
Пример графика, соответствующего рассматриваемому закону, приведен выше. Кривая P(V) называется изотермой и представляет собой гиперболу.
Пример задачи
Покажем, как следует пользоваться формулой закона Бойля-Мариотта для решения задач.
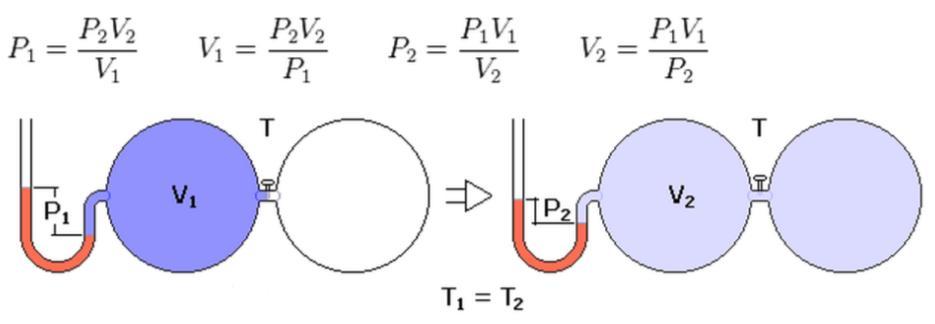
Известно, что в результате изотермического процесса давление в системе с идеальным газом уменьшилось с 105 Па до 104 Па. Насколько изменился ее объем при этом, если в начале процесса он был равен 10 литрам.
Запишем закон изотермического расширения газа в следующей форме:
P1*V1 = P2*V2.
Отсюда можно выразить значение объема V2 и вычислить его:
V2 = P1*V1/P2;
V2 = 105/104*10 = 100 литров.
Отметим, что при вычислении объема мы не переводили данные в систему СИ, поскольку единицы измерения давления сократились. Осталось найти разницу между конечным и начальным объемом, чтобы получить ответ на вопрос задачи: V2 - V1 = 90 литров.
