Знание определений в физике является ключевым фактором для успешного решения разных физических проблем. В статье рассмотрим, что понимают под процессами изобарным, изохорным, изотермическим и адиабатным для идеальной газовой системы.
Идеальный газ и его уравнение
Прежде чем переходить к описанию изобарного, изохорного и изотермического процессов, рассмотрим, что такое идеальный газ. Под этим определением в физике полагают систему, состоящую из огромного количества безразмерных и невзаимодействующих частиц, которые движутся с большими скоростями во всех направлениях. По сути, речь идет о газовом агрегатном состоянии вещества, в котором расстояния между атомами и молекулами намного превышают их размеры и в котором потенциальной энергией взаимодействия частиц пренебрегают ввиду ее малости, по сравнению с энергией кинетической.
 Вам будет интересно:Такие обычные люди, или значение «почему бы и нет»
Вам будет интересно:Такие обычные люди, или значение «почему бы и нет»
Состоянием идеального газа называется совокупность его термодинамических параметров. Главными из них являются температура, объем и давление. Обозначим их буквами T, V и P, соответственно. В 30-е годы XIX века Клапейрон (французский ученый) впервые записал уравнение, которое объединяет указанные термодинамические параметры в рамках единого равенства. Оно имеет вид:
P*V = n*R*T,
где n и R - вещества количество и газовая константа соответственно.
Что такое изопроцессы в газах?
Как многие заметили, изобарный, изохорный и изотермический процессы в своем названии используют одну и ту же приставку "изо". Она означает равенство одного термодинамического параметра во время прохождения всего процесса, при этом остальные параметры изменяются. Например, изотермический процесс говорит о том, что в его результате абсолютная температура системы поддерживается постоянной, а изохорный процесс свидетельствует о постоянстве объема.
Изопроцессы удобно изучать, поскольку фиксация одного из термодинамических параметров приводит к упрощению общего уравнения состояния газа. Важно отметить, что газовые законы для всех названных изопроцессов были открыты экспериментально. Их анализ позволил Клапейрону получить приведенное универсальное уравнение.
Изобарный, изохорный и изотермический процессы
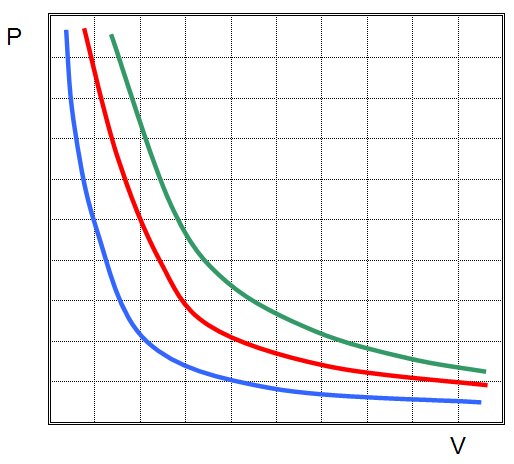
Первым был открыт закон для изотермического процесса в идеальном газе. Сейчас он называется законом Бойля-Мариотта. Поскольку T не изменяется, то из уравнения состояния следует равенство:
P*V = const.
Иными словами, любое изменение давления в системе приводит к обратно пропорциональному изменению ее объема, если поддерживать постоянной температуру газа. Графиком функции P(V) является гипербола.
Изобарный процесс - это такое изменение состояния системы, при котором давление остается постоянным. Зафиксировав величину P в уравнении Клапейрона, получаем следующий закон:
V/T = const.
Это равенство носит фамилию французского физика Жака Шарля, который получил его в конце XVIII века. Изобара (графическое изображение функции V(T)) выглядит как прямая линия. Чем больше давление в системе, тем быстрее возрастает эта линия.
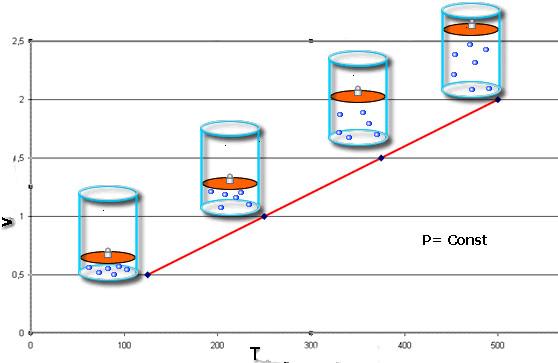
Изобарный процесс легко осуществить, если под поршнем нагревать газ. Молекулы последнего увеличивают свою скорость (кинетическую энергию), создают более высокое давление на поршень, что приводит к расширению газа и поддержанию постоянной величины P.
Наконец, третий изопроцесс - изохорный. Он проходит с постоянным объемом. Из уравнения состояния получаем соответствующее равенство:
P/T = const.
Оно среди физиков известно как закон Гей-Люссака. Прямая пропорциональность между давлением и абсолютной температурой говорит о том, что график изохорного процесса, как и график изобарного, представляет собой прямую линию с положительным коэффициентом наклона.
Важно понимать, что все изопроцессы протекают в закрытых системах, то есть в их ходе величина n сохраняется.
Адиабатный процесс
Этот процесс не относится к категории "изо", поскольку при его прохождении изменяются все три термодинамических параметра. Адиабатным называют переход между двумя состояниями системы, при котором она не обменивается теплотой с окружающей средой. Так, расширение системы осуществляется за счет ее внутренних запасов энергии, что приводит к значительному падению давления и абсолютной температуры в ней.
Адиабатный процесс для идеального газа описывают уравнениями Пуассона. Одно из них приводится ниже:
P*Vγ = const,
где γ - это отношение теплоемкостей при постоянном давлении и при постоянном объеме.
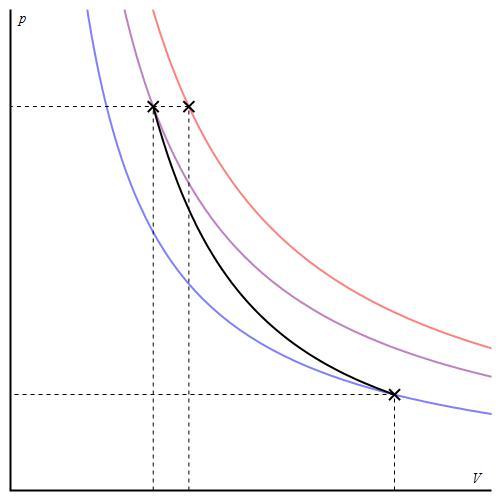
График адиабаты отличается от графика изохорного процесса и от графика изобарного, однако он похож на гиперболу (изотерму). Адиабата в осях P-V ведет себя более резко, чем изотерма.
