Главным предметом изучения термодинамики газовых систем является изменение термодинамических состояний. В результате таких изменений газ может совершать работу и запасать внутреннюю энергию. Изучим в приведенной ниже статье разные термодинамические переходы в идеальном газе. Особое внимание будет уделено изучению графика изотермического процесса.
Идеальные газы
Уже судя по самому названию, можно сказать, что 100-процентных идеальных газов в природе не существует. Однако многие реальные вещества удовлетворяют этой концепции с приемлемой для практики точностью.
 Вам будет интересно:Осадить — это... Толкование слова
Вам будет интересно:Осадить — это... Толкование слова
Идеальным называется любой газ, в котором можно пренебречь взаимодействиями между его частицами и их размерами. Оба условия удовлетворяются только в том случае, если кинетическая энергия молекул будет намного превышать потенциальную энергию связей между ними, а расстояния между молекулами будут намного больше размеров частиц.
Чтобы определить, является ли изучаемый газ идеальным, можно воспользоваться простым эмпирическим правилом: если температура в системе выше комнатной, давление не сильно отличается от атмосферного или меньше него, а составляющие систему молекулы являются химически инертными, то газ будет идеальным.
Главный закон
 Вам будет интересно:Формулы вычисления ускорения через скорость. Пример задачи
Вам будет интересно:Формулы вычисления ускорения через скорость. Пример задачи

Речь идет об уравнении идеального газа, которое также называется законом Клапейрона-Менделеева. Записано это уравнение было в 30-е годы XIX века французским инженером и физиком Эмилем Клапейроном. Спустя несколько десятилетий оно было приведено русским химиком Менделеевым к современному виду. Это уравнение имеет следующий вид:
P * V = n * R * T.
В левой части равенства стоит произведение давления P на объем V, в правой части равенства - произведение температуры T на количество вещества n. Величина R - это универсальная газовая константа. Отметим, что T - это абсолютная температура, которая измеряется в кельвинах.
Закон Клапейрона-Менделеева впервые был получен из результатов предыдущих газовых законов, то есть в его основе лежала исключительно экспериментальная база. С развитием современной физики и кинетической теории текучих сред уравнение идеального газа может быть выведено из рассмотрения микроскопического поведения частиц системы.
Изотермический процесс
Независимо от того, происходит этот процесс в газах, в жидкостях или твердых телах, он имеет вполне четкое определение. Изотермическим называется такой переход между двумя состояниями, при котором температура системы сохраняется, то есть остается неизменной. Поэтому графиком изотермического процесса в осях времени (ось x) - температуры (ось y) будет горизонтальная линия.
Касательно газа идеального отметим, что изотермический переход для него называется законом Бойля-Мариотта. Обнаружен этот закон был экспериментальным путем. Причем он стал первым в этой области (вторая половина XVII века). Его может получить каждый школьник, если рассмотрит поведение газа в закрытой системе (n = const) при постоянной температуре (T = const). Пользуясь уравнением состояния, получаем:
n * R * T = const =>
P * V = const.
Последнее равенство представляет собой закон Бойля-Мариотта. В учебниках по физике можно также встретить такую форму его записи:
P1 * V1 = P2 * V2.
При переходе из изотермического состояния 1 в термодинамическое 2 произведение объема на давление остается постоянным для закрытой газовой системы.
Изучаемый закон говорит об обратной пропорциональности между величинами P и V:
P = const / V.
Это означает, что графиком изотермического процесса в идеальном газе будет кривая гипербола. Три гиперболы изображены на рисунке ниже.
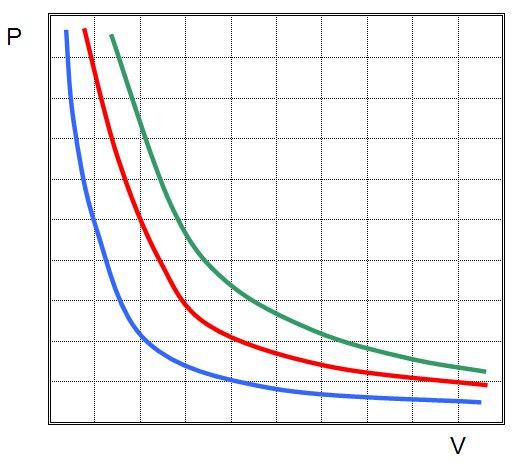
Каждая из них называется изотермой. Чем выше температура в системе, тем дальше от осей координат будет стоять изотерма. Из рисунка выше можно сделать вывод, что зеленая соответствует самой высокой температуре в системе, а синяя - самой низкой при условии, что количество вещества во всех трех системах является одинаковым. Если же все изотермы на рисунке построены для одной температуры, то это означает, что зеленая кривая соответствует самой большой в плане количества вещества системе.
Изменение внутренней энергии при изотермическом процессе
В физике идеальных газов под внутренней энергией понимают энергию кинетическую, связанную с вращательным и поступательным движением молекул. Из кинетической теории несложно получить следующую формулу для внутренней энергии U:
U = z / 2 * n * R * T.
Где z - это число степеней свободного движения молекул. Оно изменяется от 3 (одноатомный газ) до 6 (многоатомные молекулы).
В случае процесса изотермического температура остается постоянной, значит, единственной причиной изменения внутренней энергии является выход или приход в систему частиц вещества. Таким образом, в закрытых системах во время изотермического изменения их состояния внутренняя энергия сохраняется.
Изобарный и изохорный процессы
Помимо закона Бойля-Мариотта, существуют еще два основных газовых закона, которые также были открыты экспериментальным путем. Они носят фамилии французов Шарля и Гей-Люссака. Математически их записывают так:
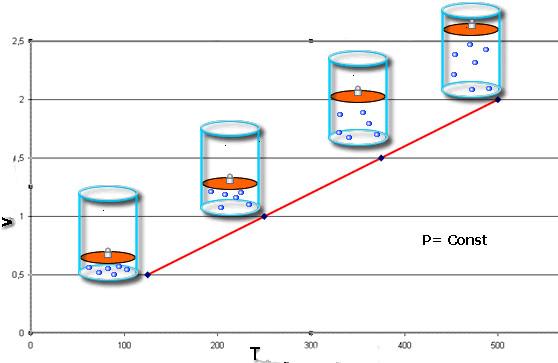
V / T = const при P = const;
P / T = const при V = const.
Закон Шарля говорит о том, что во время изобарного процесса (P = const) объем линейно зависит от абсолютной температуры. Закон Гей-Люссака свидетельствует о линейной зависимости между давлением и абсолютной температурой при изохорном переходе (V = const).
Из приведенных равенств следует, что от процесса изотермического графики изобарного и изохорного переходов отличаются существенным образом. Если изотерма имеет форму гиперболы, то изобара и изохора являются прямыми линиями.
Изобарно-изотермический процесс
Рассматривая газовые законы, иногда забывают, что, помимо величин T, P и V, также может изменяться и величина n в законе Клапейрона-Менделеева. Если зафиксировать давление и температуру, то мы получим уравнение изобарно-изотермического перехода:
n / V = const при T = const, P = const.
Линейная зависимость между количеством вещества и объемом говорит о том, что при одинаковых условиях разные газы, содержащие одно и то же количество вещества, занимают равные объемы. Например, при нормальных условиях (0 oC, 1 атмосфера) молярный объем любого газа составляет 22,4 литра. Рассмотренный закон называется принципом Авогадро. Он лежит в основе закона Дальтона об идеальных газовых смесях.