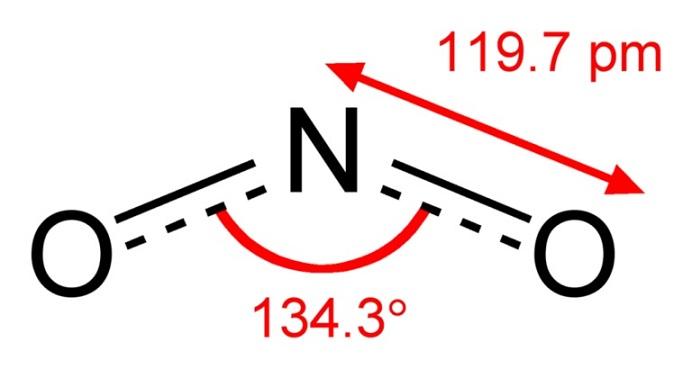
Нитрит-ион — это ион, состоящий из одного атома азота и двух атомов кислорода. Азот в этом ионе имеет заряд +3, следовательно заряд всего иона -1. Частица одновалентна. Формула нитрит-иона NO2-. Анион имеет нелинейную конфигурацию. Соединения, содержащие эту частицу, называются нитритами, например нитрита натрия — NaNO2, нитрит серебра — AgNO2.
Физические и химические свойства
Нитриты щелочных, щелочноземельных металлов и аммония представляют собой бесцветные или слегка желтоватые кристаллические вещества. Нитриты калия, натрия, бария в воде хорошо растворяются, нитриты серебра, ртути, меди – плохо. С повышением температуры растворимость повышается. Практически все нитриты плохо растворяются в эфирах, спиртах и малополярных растворителях.
 Вам будет интересно:Явление внутреннего полного отражения и его примеры в быту и природе
Вам будет интересно:Явление внутреннего полного отражения и его примеры в быту и природе
Таблица. Физические характеристики некоторых нитритов.
| Характеристика | Нитрит калия | Нитрит серебра | Нитрит кальция | Нитрит бария |
|
Тпл, °С |
440 |
120 (с разлож.) |
220 (с разлож.) |
277 |
|
∆H0обр, кДж/моль |
- 380,0 | - 40,0 | -766,0 | - 785,5 |
| S0298, Дж/(моль*К) | 117,2 | 128,0 | 175,0 | 183,0 |
| Раствор-ть в воде, г в 100 г |
306,7 (200С) |
0,41 (250С) |
84,5 (180С) |
67,5 (200С) |
Нитриты малоустойчивы к нагреванию: без разложения плавятся только нитриты щелочных металлов. В результате разложения выделяются газообразные продукты — O2 , NO, N2, NO2, и твердые вещества — оксид металла или сам металл. Например, разложение нитрита серебра(идет уже при 40 °С) сопровождается выделением элементного серебра и оксида азота (II):
2AgNO2 = AgNO3 + Ag + NO↑
Поскольку разложение идет с выделением большого количества газов, реакция может идти с взрывом, например, в случае нитрита аммония.
Окислительно-восстановительные свойства
Атом азота в нитрит-ионе имеет промежуточный заряд +3, вот почему для нитритов характерны как окислительные, так и восстановительные свойства. К примеру, нитриты будут обесцвечивать раствор калия перманганата в кислой среде, проявляя свойства окислителя:
5KNO2 + 2KMnO4 +3H2SO4 = 3H2O + 5KNO3 + 2MnSO4 + K2SO4
 Вам будет интересно:Пополняем словарный запас: расточительство — это...
Вам будет интересно:Пополняем словарный запас: расточительство — это...
Свойства восстановителя нитрит-ионы проявляют, например, в реакции с крепким раствором пероксида водорода:
NO2- + H2O2 = NO3- + H2O
Восстановителем является нитрит при взаимодействии с броматом серебра (подкисленный раствор). Эта реакция используется в химическом анализе:
2NO2- + Ag+ + BrO2- = 2NO3- + AgBr↓
Еще одним примером восстановительных свойств является качественная реакция на нитрит-ион — взаимодействие бесцветных растворов [Fe(H2O)6]2+ с подкисленным раствором нитрита натрия с появлением бурого окрашивания.
Теоретические основы обнаружения NO2¯
Азотистая кислота при нагревании диспропорционирует с образованием оксида азота (II) и азотной кислоты:
HNO2 + 2HNO2 = NO3- + H2O + 2NO↑ + H+
Поэтому азотистую кислоту невозможно отделить от азотной кипячением. Как видно из уравнения, азотистая кислота, разлагаясь, частично превращается в азотную, что приведет к ошибкам в определении содержания нитратов.
Почти все нитриты растворяются в воде, наименее растворимым из этих соединений является нитрит серебра.
Нитрит-ион сам бесцветен, поэтому его выявляют реакциями образования других окрашенных соединений. Нитриты неокрашенных катионов также бесцветны.
Качественные реакции
Существует несколько качественных способов определения нитрит-ионов.
1. Реакция образования K3[Co(NO2)6].
В пробирку помещают 5 капель исследуемого раствора, содержащего нитрит, 3 капли раствора нитрата кобальта, 2 капли уксусной кислоты (разбавленной), 3 капли раствора хлорида калия. Образуется гексанитрокобальтат (III) K3[Co(NO2)6] - желтый кристаллический осадок. Нитрат-ион в исследуемом растворе не мешает обнаружению нитритов.
2. Реакция окисления иодидов.
Нитрит-ионы окисляют иодид-ионы в кислой среде.
2HNO2 + 2I- + 2H+ = 2NO↑ + I2↓ + 2H2O
В ходе реакции образуется элементарный иод, который легко обнаружить окрашиванием крахмала. Для этого реакцию можно проводить на фильтровальной бумаге, предварительно пропитанной крахмалом. Реакция очень чувствительна. Синий цвет появляется даже при наличии следов нитритов: открываемый минимум – 0,005 мкг.
Фильтровальную бумагу пропитывают крахмальным раствором, добавляют на нее 1 каплю 2н раствора уксусной кислоты, 1 каплю опытного раствора, 1 каплю 0,1н раствора иодида калия. При наличии нитрита появляется синее кольцо или пятно. Обнаружению мешают другие окислители, приводящие к образованию иода.
3. Реакция с перманганатом калия.
В пробирку помещают 3 капли раствора калия перманганата , 2 капли серной кислоты (разбавленной). Смесь нужно нагреть до 50-60 °С. Добавляют осторожно несколько капель нитрита натрия или калия. Раствор перманганата обесцвечивается. Другие восстановители, присутствующие в исследуемом растворе, способные окислить перманганат-ион, будут мешать выявлению NO2-.
4. Реакция с сульфатом железа (II).
Сульфат железа восстанавливает нитрит в нитрат в кислой среде (разбавленная серная кислота):
2KNO2 (тв.) + 2H2SO4 (разб.) + 2FeSO4 (тв.) = 2NO↑ + K2SO4 + Fe2(SO4)3 + 2H2O
Получившийся оксид азота (II) образует с избытком Fe2+ (не успевшими еще вступить в реакцию) комплексные ионы бурого цвета:
NO + Fe2+ = [FeNO]2+
NO + FeSO4 = [FeNO]SO4
Следует учесть, что с разбавленной серной кислотой реагируют нитриты, а с концентрированной будут реагировать нитраты. Поэтому для выявления нитрит-иона необходима именно разбавленная кислота.
5. Реакция с антипирином.
NO2- с антипирином в кислой среде дает раствор зеленого цвета.
6. Реакция с риванолом.
NO2- с риванолом, или этакридином (I) в кислой среде дает раствор красного цвета.
Количественное определение содержания нитритов в воде
По ГОСТу количественное содержание нитрит-ионов в воде определяют двумя фотометрическими методами: с использованием сульфаниловой кислоты и с использованием 4-аминобензолсульфонамида. Первый из них является арбитражным.
Из-за нестойкости нитритов их нужно определять сразу после взятия проб или же консервировать пробы добавлением на 1 л воды 1 мл серной кислоты (концентрированной) или 2-4 мл хлороформа; можно охладить пробу до 4 °С.
Мутную или цветную воду очищают гидроокисью алюминия, добавляя 2-3 мл суспензии на 250-300 мл воды. Смесь встряхивают, для анализа отбирают прозрачный слой после осветления.
Определение содержания нитритов с помощью сульфаниловой кислоты

Сущность метода: нитриты анализируемой пробы взаимодействуют с сульфаниловой кислотой, полученная соль реагирует 1-нафтиламином с выделением красно-фиолетового азокрасителя, его количество определяют фотометрически, затем проводят расчет концентрации нитритов в пробе воды. 1-нафтиламин и сульфаниловая кислота и входят в состав реактива Грисса.
Определение нитрит-ионов: методика
К 50 мл пробы воды приливают 2 мл раствора реактива Грисса в уксусной кислоте. Перемешивают и выдерживают 40 мин при обычной температуре или 10 мин при 50-60 °С на водяной бане. Затем замеряют оптическую плотность смеси. В роли холостой пробы применяют дистиллированную воду, которую готовят аналогично пробе анализируемой воды. Концентрацию нитритов рассчитывают по формуле:
X=K∙A∙50∙f / V,
где: K – коэффициент градуировочной характеристики,
A – установленное значение оптической плотности анализируемой пробы воды за вычетом установленного значения оптической плотности холостой пробы,
50 – объем мерной колбы,
f – коэффициент разбавления (если пробу не разбавляли, f=1),
V – объем аликвоты, взятой для анализа.
Нитриты в воде
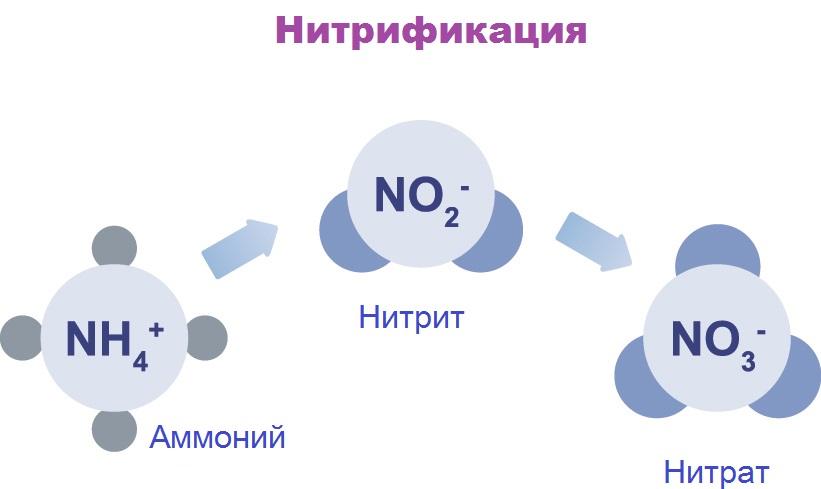
Откуда нитрит-ионы в сточных водах? Нитриты в небольшом количестве всегда присутствуют в дождевой воде, поверхностных и подземных водах. Нитриты — промежуточная ступень в превращениях азотосодержащих веществ, осуществляемых бактериями. Эти ионы образуются при окислении катиона аммония до нитратов (в присутствии кислорода) и при противоположных реакциях – восстановления нитратов до аммиака или азота (при недостатке кислорода). Все эти реакции осуществляются бактериями, а источником азотосодержащих веществ является органика. Поэтому количественное содержание нитритов в воде – важный санитарный показатель. Превышение норм содержания нитритов говорит о фекальном загрязнении вод. Попадание стоков животноводческих ферм, заводов, промышленных предприятий, загрязнение водоемов водами с полей, где применялись азотные удобрения – основные причины высокого содержания нитритов в воде.
Получение
В промышленности нитрит натрия получают абсорбцией нитрозного газа (смесь NO и NO2) растворами NaOH или Na2CO3 с последующей кристаллизацией нитрита натрия:
NO + NO2 + 2NaOH (хол.)= 2NaNO2 + H2O
Реакция в присутствии кислорода идет с образованием нитрата натрия, поэтому необходимо обеспечить бескислородные условия.
Таким же методом в промышленности получают и нитрит калия. Кроме того, нитриты натрия и калия можно получить окислением свинца нитратом:
KNO3 (конц) + Pb (губка) + H2O = KNO2 + Pb(OH)2↓
KNO3 + Pb = KNO2 + PbO
Последняя реакция идет при температуре 350-400 °С.