В конце XVIII и в первой половине XIX века ученые разных стран активно изучали поведение газообразной, жидкой и твердой материи при различных внешних условиях, опираясь в своих исследованиях на представления об атомном и молекулярном строении вещества. Одним из таких ученых был британец Джон Дальтон. Закон для смеси газов, который в настоящее время носит его фамилию, рассматривается в данной статье.
Особые условия
Прежде чем формулировать закон Дальтона для смеси газов, следует разобраться с одним из понятий. Это очень важно, поскольку только для такого вещества справедлив этот закон. Речь идет об идеальном газе. Что же это такое?
 Вам будет интересно:Система общественного устройства государства
Вам будет интересно:Система общественного устройства государства
Под идеальным полагается газ, для которого справедливы следующие требования:
- размеры молекул и атомов в нем настолько малы, что их можно считать материальными точками, имеющими нулевой объем;
- молекулы и атомы не взаимодействуют между собой.
Таким образом, идеальный газ представляет собой совокупность материальных точек, движущихся хаотично. Скорость их движения и масса однозначно определяют температуру всей смеси. Давление, которое исследуемое вещество оказывает на стенки сосуда, зависит от таких макроскопических параметров, как температура, объем сосуда и число молекул.
Для такой газовой модели справедливо равенство:
P*V = n*R*T
Оно называется уравнением состояния и объединяет давление (P), температуру (T), объем (V) и количество вещества в молях (n). Величина R – это коэффициент пропорциональности, который равен 8,314 Дж/(К*моль).
Удивительное в этой формуле то, что она не включает ни одного параметра, который бы зависел от химической природы молекул и атомов.
Идеальными можно считать практически любые газы и их смеси, если температура не слишком низкая, а давление не слишком большое. Обратите внимание! Комнатная температура и атмосферное давление попадают в эти пределы.
Парциальное давление
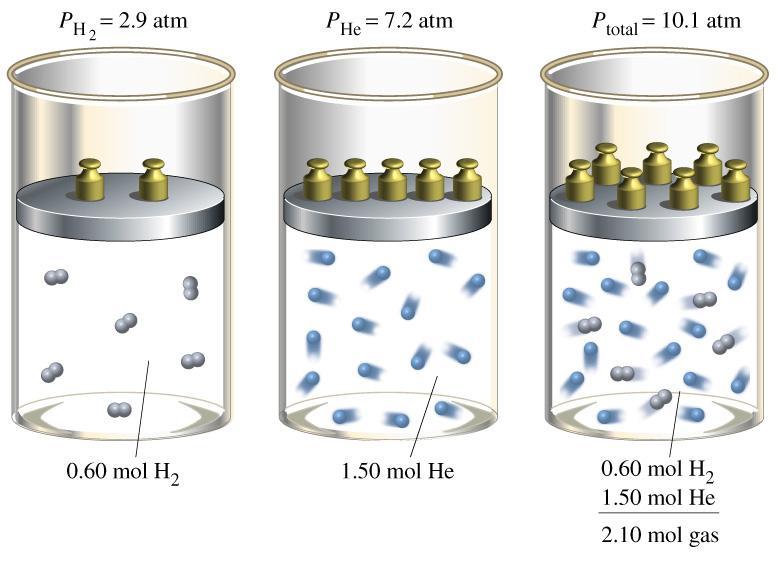
Закон Дальтона для смеси газов идеальных предполагает знание еще об одном макроскопическом параметре – парциальном давлении.
Предположим, что имеется некоторая смесь, состоящая из 2-х компонентов, например, H2 и He. Эта смесь находится в сосуде конкретного объема и на его стенки создает определенное давление. Поскольку молекулы водорода и атомы гелия не взаимодействуют друг с другом, тогда для любых расчетов макроскопических характеристик оба компонента можно рассматривать независимо друг от друга.
Парциальным давлением компонента называется давление, которое он создает независимо от остальных компонентов смеси, занимая предоставленный ему объем. В рассматриваемом примере можно говорить о парциальном давлении H2 и такой же характеристики для He. Эта величина выражается в паскалях и обозначается для i-го компонента как Pi.
Газовые смеси и закон Дальтона

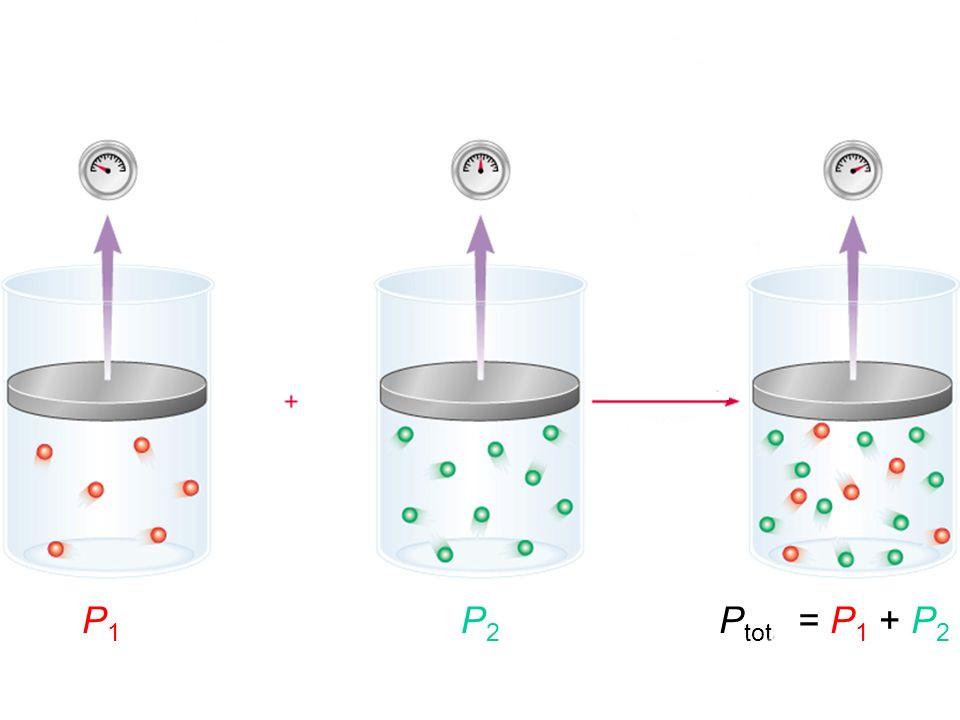
Джон Дальтон, изучая различные летучие, включая водяной пар, при разных температурах и давлениях, пришел к следующему выводу: давление смеси совершенно любых подобных веществ в любых пропорциях равно сумме парциальных давлений всех его компонентов. Эта формулировка называется законом Дальтона для давления смеси газов и записывается следующим математическим равенством:
Ptot = ∑i(Pi)
Здесь Ptot – полное давление смеси.
Этот достаточно простой закон выполняется только для идеальных газовых смесей, компоненты которых не взаимодействуют химически друг с другом.
Другая формулировка закона Дальтона
Закон Дальтона для смеси газов может быть выражен не только через парциальные давления, но также через мольные доли каждого компонента. Получим соответствующую формулу.
Поскольку каждый компонент ведет себя независимо от других в газовой смеси, тогда для него можно записать уравнение состояния:
Pi*V = ni*R*T
Это уравнение справедливо для каждого i-го компонента, поскольку для всех них температура T и объем V являются одинаковыми. Величина ni – это количество молей компонента i в смеси.
Выразим теперь парциальное давление, и разделим его на полное давление всей смеси, тогда получим:
Pi/Ptot = ni*R*T / V / (n *R*T/V) = ni/n
Здесь n - общее количество вещества во всей смеси. Его можно получить, если просуммировать все ni. Отношение ni/n называется мольной долей компонента i в смеси. Ее обычно обозначают символом xi. Через мольные доли закон Дальтона записывается так:
Pi = Ptot*xi
Мольная доля часто представляется в виде атомных процентов компонентов в смеси. Например, 21 % O2 в воздухе говорит о том, что его мольная доля равна 0,21, то есть каждая пятая молекула воздуха является кислородом.
Применение рассмотренного закона для решения задачи

Известно, что газовая смесь из кислорода и азота находится под давлением 5 атмосфер в баллоне. Зная, что в нем содержится 10 моль азота и 3 моль кислорода, необходимо определить парциальное давление каждого вещества.
Чтобы ответить на вопрос задачи, найдем сначала общее количество вещества:
n = nN2 + nO2 = 10 + 3 = 13 моль
Теперь можно рассчитать мольную долю каждого компонента в смеси. Имеем:
xN2 = nN2/n = 10/13 = 0,7692
xO2 = nO2/n = 3/13 = 0,2308
Пользуясь формулой закона Дальтона через мольную долю компонента, рассчитываем парциальное давление каждого газа в баллоне:
PN2 = 5*0,7692 = 3,846 атм.
PO2 = 5*0,2308 = 1,154 атм.
Как видно из полученных цифр, сумма этих давлений даст 5 атмосфер. Парциальное давление каждого газа прямо пропорционально его мольной доли в смеси.
